Содержание
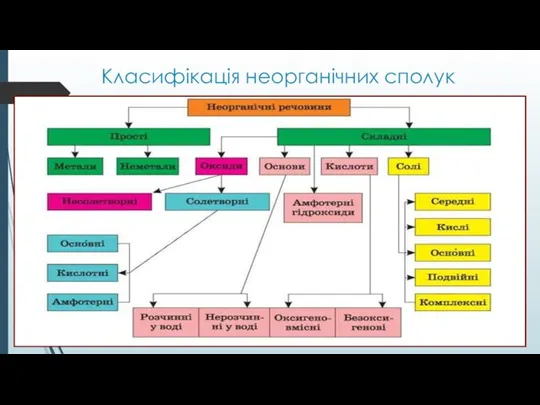
- 2. Класифікація неорганічних сполук
- 3. 1. Методи отримання оксидів металів 1.1. Реакції окиснення 1.2. Гідроліз 1.3. Термічне розкладання 1.4. Реакції відновлення
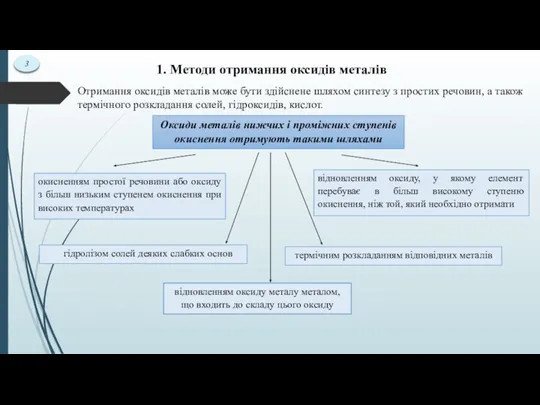
- 4. 1. Методи отримання оксидів металів Отримання оксидів металів може бути здійснене шляхом синтезу з простих речовин,
- 5. Реакції окиснення Отримання оксидів металів за допомогою реакцій окиснення можна підрозділити на 3 групи реакцій: Окиснення
- 6. 5 Реакції гідролізу Оксиди деяких металів у ступенях окиснення, у яких вони утворюють слабки основи, що
- 7. 6 Термічне розкладання Метод термічного розкладання дуже простий і знаходить широке застосування. Як вихідні речовини для
- 8. 7 Реагенти для отримання і властивості деяких оксидів металів
- 9. 8 Реакції відновлення Якщо метал може мати кілька ступенів окиснення, його нижчі оксиди можна отримати з
- 10. 9 Методи отримання оксидів неметалів Більшість методів отримання оксидів неметалів ґрунтується на тих же принципах, що
- 11. Також можливе отримання оксидів неметалів шляхом окиснення їх сполук, у які вони входять у більш низьких
- 12. 11 або спонтанне розкладання при нагріванні або вже при кімнатній температурі деяких кислот на відповідний оксид
- 13. 12 Термічне розкладання Оксиди також утворюються у результаті прожарювання деяких солей оксигеновмісних кислот. Такі реакції можливі
- 14. 13 Протоліз Метод протолізу полягає в отриманні ангідридів нестійких кислот шляхом витіснення цих кислот з їх
- 15. 14 Окисно-відновні реакції Оксиди утворюються також як продукт деяких окисно-відновних реакцій, чим іноді користуються для їх
- 16. 15 Отримання гідроксидів і кислот Найпоширенішим методом отримання слабких основ є осадження їх з розчинів солей
- 17. 16 Безоксигенні кислоти отримують, розчиняючи у воді відповідні сполуки неметалів з гідрогеном. Безпосередньою взаємодією з воднем
- 18. 17 Cпособи отримання оксигеновмісних кислот Витіснення летких кислот менш леткими: NaNO3 + H2SO4 → NaHSO4 +
- 19. 18 4. Методи отримання солей
- 20. 19 Методи отримання галогенідів 1. Взаємодія простої речовини з галогеном у вільному стані
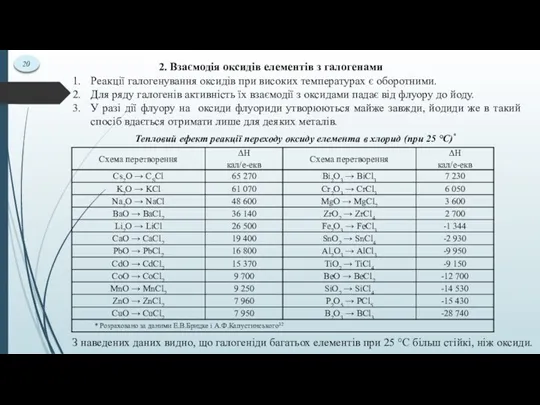
- 21. 20 2. Взаємодія оксидів елементів з галогенами Реакції галогенування оксидів при високих температурах є оборотними. Для
- 22. 21 Оксиди лужних і лужноземельних металів дуже легко переходять у хлориди під дією хлору, у той
- 24. Скачать презентацию


















 Алкины. Химические свойства и способы получения алкинов
Алкины. Химические свойства и способы получения алкинов Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов
Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Правила техники безопасности при работе в кабинете химии
Правила техники безопасности при работе в кабинете химии Титан. Хром
Титан. Хром Основные разделы химии
Основные разделы химии Субстраты и продукты биохимических реакций
Субстраты и продукты биохимических реакций Хромотография, явления, атомы и молекулы. 8 класс
Хромотография, явления, атомы и молекулы. 8 класс Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Ионная хроматография
Ионная хроматография Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Щелочные металлы. 9 класс
Щелочные металлы. 9 класс История органической химии. Характерные особенности органических соединений
История органической химии. Характерные особенности органических соединений Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства
Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства Электрохимические процессы
Электрохимические процессы Alkynes
Alkynes Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Теория возникновения электродных и ОВ-потенциалов
Теория возникновения электродных и ОВ-потенциалов Аммиак
Аммиак Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс
Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс Химические свойства кислот
Химические свойства кислот Взаємодія кисеню зі складними речовинами
Взаємодія кисеню зі складними речовинами Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Железо. Строение атома, физические и химические свойства простого вещества
Железо. Строение атома, физические и химические свойства простого вещества Влияние этилового спирта на организм детей
Влияние этилового спирта на организм детей