Содержание
- 2. Ионизация происходит под действием полярных Образующиеся при этом молекул растворителя (воды). электроны концентрируются на пластинке, заряжая
- 3. Ме + mH2O ⇄ Меn+ ⋅ mH2O + nē или упрощенно: Ме ⇄ Меn+ + nē
- 4. Значения электродных потенциалов рассчитывают по уравнению Нернста: ϕ Меn+/Ме= ϕ0 Меn+/Ме +RT/nF ln aМеn+ где ϕ0
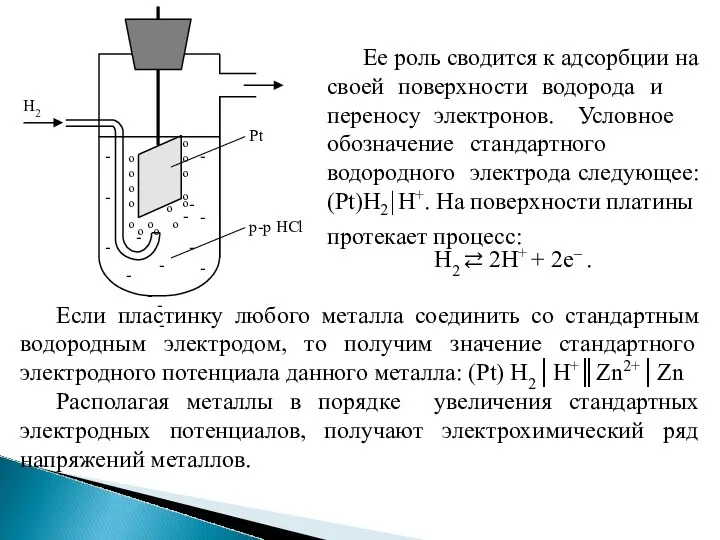
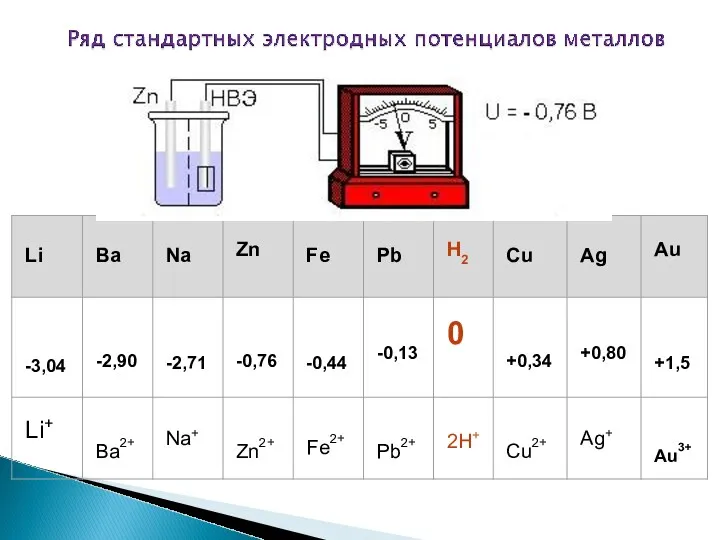
- 5. Стандартные электродные потенциалы Стандартный водородный электрод Абсолютное значение электродного потенциала в настоящее время измерить или невозможно.
- 6. о о о о о о о о o o oo o o Pt р-р HCl
- 8. По механизму возникновения электродного потенциала электроды делятся на обратимые и необратимые . Медики встречаются с обратимыми
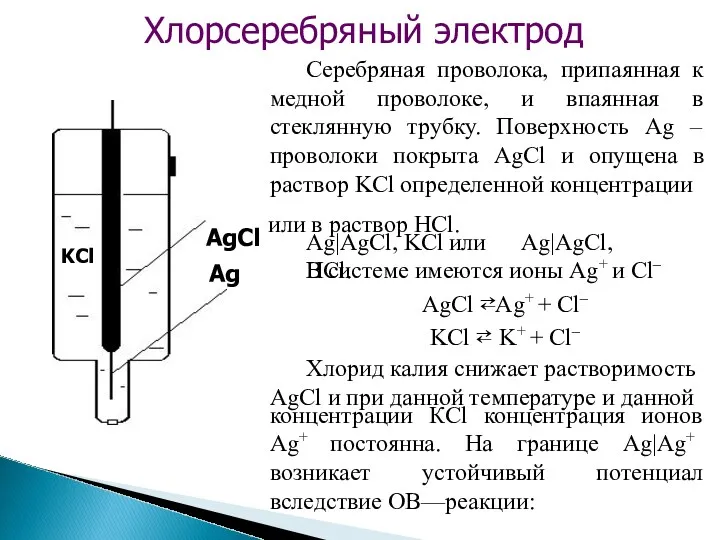
- 9. Каломелевый электрод Hg|Hg2Cl2, KCl. Хлорсеребряный электрод Аg|АgCl, KCl. Вычисляется потенциал такого электрода по формуле: По своему
- 10. Хлорсеребряный электрод Ag KCl Серебряная проволока, припаянная к медной проволоке, и впаянная в стеклянную трубку. Поверхность
- 11. АgCl(т.) + ē ⇄ Аg0(т) + Cl– и Cl– и Этот потенциал зависит от активности ионов
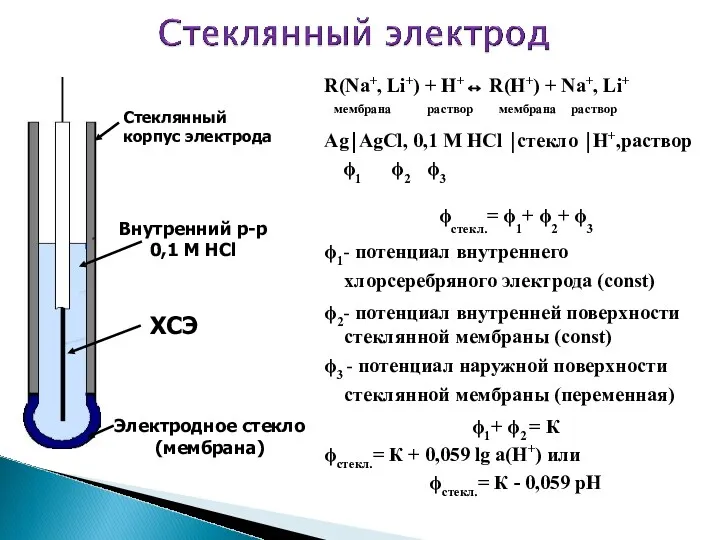
- 12. R(Na+, Li+) + H+↔ R(H+) + Na+, Li+ мембрана раствор мембрана раствор Ag⏐AgCl, 0,1 M HCl
- 13. Стеклянный электрод – ионселективный электрод, потенциал которого зависит только от активности Н+. В электродной реакции не
- 14. Потенциометрия основанный на определении зависимости Экспериментальный метод исследования и анализа, между равновесным электродным потенциалом Е и
- 15. Однако, изменяя состав стекол (введение в стекло оксидов алюминия и бора) можно получить стекло, электроды из
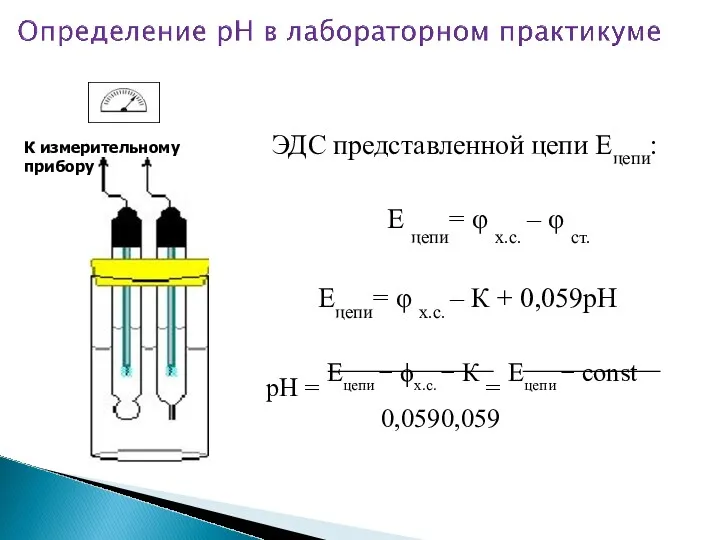
- 16. ЭДС представленной цепи Ецепи: К измерительному прибору Е цепи= φ х.с. – φ ст. Ецепи= φ
- 17. Гальванические элементы Гальванический элемент (химический источник тока) — это устройство, в котором химическая энергия окислительно- реакции
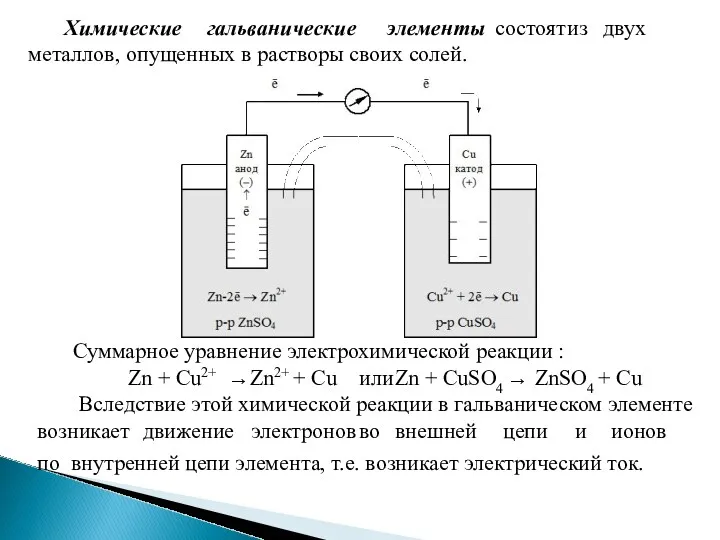
- 18. Химические гальванические элементы состоят из двух металлов, опущенных в растворы своих солей. Суммарное уравнение электрохимической реакции
- 19. Схема химического гальванического элемента записывается по правилу «правого плюса». То есть электрод, являющийся катодом (+), пишется
- 20. Отсюда ЭДС медно-цинкового гальванического элемента равна: 2+ Cu /Cu Е=ϕ –ϕ 2+ Zn /Zn =ϕ0 2+
- 21. Гальванический элемент служит источником тока до тех пор, пока весь цинковый электрод (анод) не растворится или
- 22. Уравнение для вычисления ЭДС концентрационных гальванических элементов имеет вид: + Ag /Ag + Ag /Ag +
- 23. ОВ-электроды – это такие электроды, в которых материал а лишь служит электродов не изменяется, электронов, получаемых
- 24. В каждой полуреакции вещество в более высокой степени окисления называется окисленной формой (Ох), а вещество в
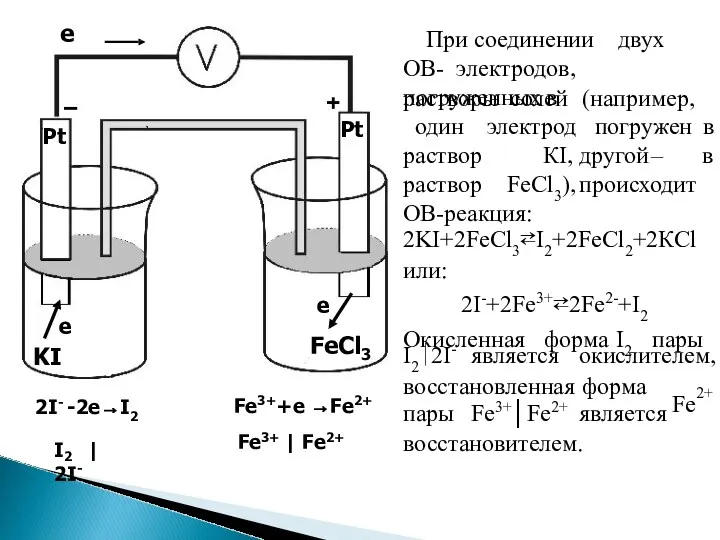
- 25. 2 I | 2I- Fe3++e →Fe2+ Fe3+ | Fe2+ Pt Pt FeCl 3 e KI 2I-
- 26. Полуреакции окисления и восстановления неосуществимы одна без другой: если есть донор электронов, должен быть акцептор. Потенциал
- 27. Если составить гальванический элемент из полуэлементов MnO4- и (Pt), Н2∣Н+, то стандартный ОВ-потенциал = + 1,51В
- 28. Для расчетов чаще используют формулу Нерста-Петерса в таком виде: или Если в сопряженную ОВ-систему входят ионы
- 29. На значение ОВ-потенциала влияет природа сопряженной ОВ- пары, соотношение активностей (концентраций) окисленной и восстановленной форм в
- 30. где q – переносимый Аэлектр-ая= q∆Е, электрический заряд, ∆Е - разность потенциалов между электродами. q =
- 31. ОВ-система, ОВ-потенциал который больше, всегда играет роль окислителя по отношению к ОВ-системе, потенциал которой меньше. Например:
- 33. Скачать презентацию























 Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов История органической химии. Характерные особенности органических соединений
История органической химии. Характерные особенности органических соединений Алкадиены CnH2n
Алкадиены CnH2n Жёсткость воды и способы её устранения. Практическая работа №6. 9 класс
Жёсткость воды и способы её устранения. Практическая работа №6. 9 класс Органическая химия. ДО. Глицерин как представитель многоатомных спиртов
Органическая химия. ДО. Глицерин как представитель многоатомных спиртов Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Химия элементов 16 (VIA) группы
Химия элементов 16 (VIA) группы Вред Coca-Cola на организм человека
Вред Coca-Cola на организм человека Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии
Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение Алкены. Строение, изомерия, номенклатура
Алкены. Строение, изомерия, номенклатура Непредельные углеводороды
Непредельные углеводороды Азотная кислота
Азотная кислота Ароматы, запахи, флюиды
Ароматы, запахи, флюиды Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы
Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы Структура и функции биомакромолекул. Лекция 1
Структура и функции биомакромолекул. Лекция 1 Переходный элемент алюминий. Свойства алюминия
Переходный элемент алюминий. Свойства алюминия Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти
Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти ХИМИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ
ХИМИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ Хімічне виробництво сталі
Хімічне виробництво сталі Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Краткая история химии
Краткая история химии Электролитическая диссоциация. Вещества в растворах
Электролитическая диссоциация. Вещества в растворах Аналитическая химия и химический анализ. (Лекция 1)
Аналитическая химия и химический анализ. (Лекция 1) Теория строения органических веществ А.М. Бутлерова
Теория строения органических веществ А.М. Бутлерова Гидрохимические определения. Методы определения растворенного кислорода в воде
Гидрохимические определения. Методы определения растворенного кислорода в воде Химия нефти и газа. Свойства нефти и нефтепродуктов. Свойства газов
Химия нефти и газа. Свойства нефти и нефтепродуктов. Свойства газов Окислительно - восстановительные реакции
Окислительно - восстановительные реакции