Слайд 2

Алкадиены
(диеновые углеводороды) – углеводороды, в молекулах которых имеются две
двойные связи, соответствующие общей формуле CnH2n – 2
Слайд 3

Классификация алкадиенов
1. Соединения, у которых две двойные связи находятся у одного
атома углерода называются алкадиенами с кумулированными связями. Например: СН2 = С = СН2 — пропандиен
Слайд 4

2. Алкадиены, у которых две двойные связи разделены более, чем одной
простой, называются алкадиенами с изолированными связями:
СН2 = СН – СН2 — СН2 – СН = СН2 – гексадиен-1,5
Слайд 5

3. Диеновые углеводороды, в молекулах которых двойные связи разделены простой (одинарной)
связью. Алкадиены с таким расположением двойных связей называются сопряженными.
СН2 = СН – СН = СН2 — бутадиен-1,3
Слайд 6

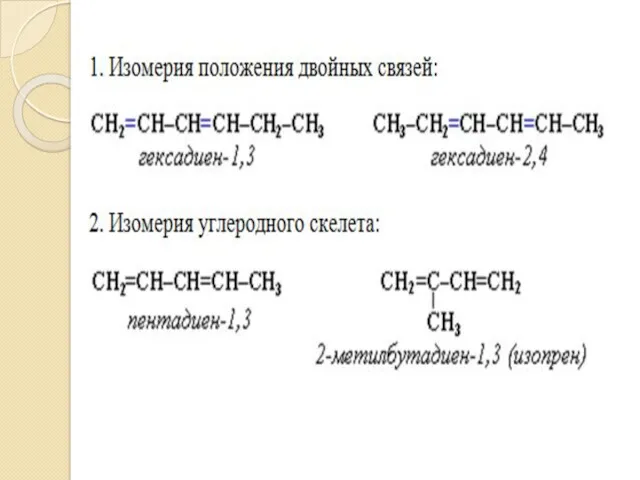
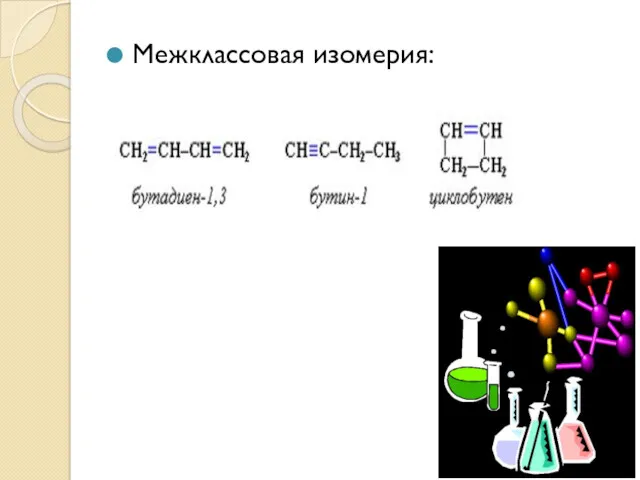
Изомерия и номенклатура алкадиенов
Названия алкадиенов происходят от соответствующих предельных углеводородов
с изменением суффикса «-ан» на «-диен».
Двойные связи должны входить в главную цепь.
Цепи нумеруют так, чтобы положения двойных связей обозначались наименьшими номерами.
Слайд 7
Слайд 8
Слайд 9
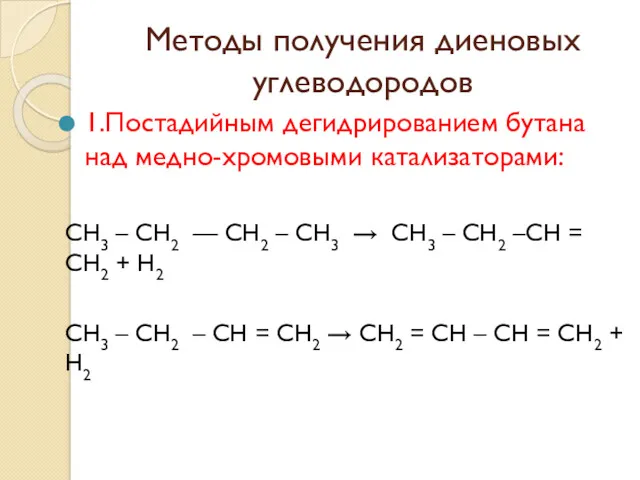
Методы получения диеновых углеводородов
1.Постадийным дегидрированием бутана над медно-хромовыми катализаторами:
СН3 – СН2 —
СН2 – СН3 → СН3 – СН2 –СН = СН2 + Н2
СН3 – СН2 – СН = СН2 → СН2 = СН – СН = СН2 + Н2
Слайд 10

2. Одновременной дегидратацией и дегидрированием этанола
(по Лебедеву С.В.)
2СН3СН2ОН → СН2 =
СН – СН = СН2 + 2Н2О + Н2
В 1932 г. в нашей стране было налажено производство бутадиена из этилового спирта методом С.В. Лебедева.
Слайд 11
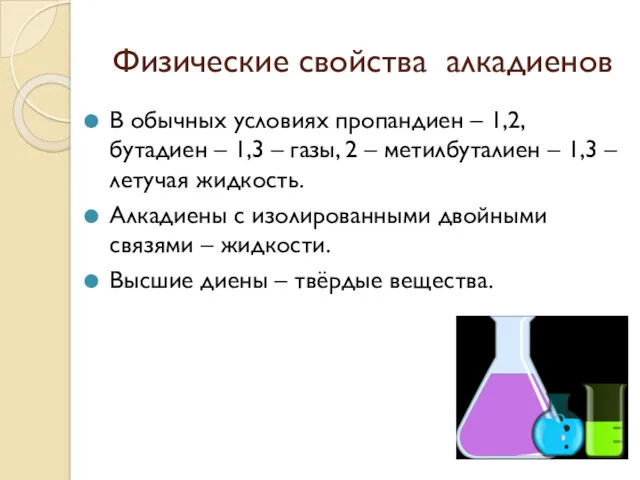
Физические свойства алкадиенов
В обычных условиях пропандиен – 1,2, бутадиен – 1,3
– газы, 2 – метилбуталиен – 1,3 – летучая жидкость.
Алкадиены с изолированными двойными связями – жидкости.
Высшие диены – твёрдые вещества.
Слайд 12

Химические свойства алкадиенов
1. Бромирование:
Характерно, что присоединение водорода, галогенов или галогеноводородов
у диенов с сопряженными связями происходит преимущественно по концам молекулы, с разрывом двойных связей:
CH2 = CH – CH = CH2 + Br2 → CH2Br – СH – CH – CH2Br
׀ ׀
Свободные валентности второго и третьего атомов углерода соединяются друг с другом, и в середине молекулы образуется двойная связь. Поэтому в окончательном виде уравнение записывают так:
CH2 = CH – CH = CH2 + Br2 → CH2Br – СH = CH – CH2Br
Слайд 13
2. Диеновым углеводородам свойственны также реакции полимеризации, которые имеют большое значение
в производстве синтетических каучуков.
nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n
Слайд 14

Из различных представителей диеновых углеводородов наибольшее значение имеют:
СН2 = СН
– СН = СН2 — бутадиен – 1,3
СН2 = С(СН3) – СН = СН2 – 2-метилбутадиен –1,3 (изопрен)
СН2 = С(CI) — СН = СН2 – 2-хлорбутадиен –1,3 (хлоропрен)
Слайд 15

Указанные диены являются основой соответственно синтетического, натурального и хлоропренового каучуков.
Каучуки представляют собой высокомолекулярные соединения, получающиеся при полимеризации диенов.
Например, при полимеризации хлоропрена получают хлоропреновый каучук:
nСН2 = С(CI) – СН = СН2 → (– СН2 – С(CI) = СН – СН2–)n
Слайд 16

Для практического использования каучуки превращают в резину.
Резина – это вулканизованный
каучук с наполнителем (сажа).
Слайд 17
3. Реакция гидрирования:
CH2 = CH – CH =CH2 + 2H2 →(t/кат)
CH3 – CH2 – CH2 – CH3
















 Титриметрический метод анализа
Титриметрический метод анализа Спирти. Загальні відомості про спирти
Спирти. Загальні відомості про спирти Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Мектепте химия пәнінен олипиядалық есептерді шешуде иондар қасиеттерінің маңызы
Мектепте химия пәнінен олипиядалық есептерді шешуде иондар қасиеттерінің маңызы Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров
Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров Как и где используется соляная кислота
Как и где используется соляная кислота Теория строения органических соединений. Лекция 17
Теория строения органических соединений. Лекция 17 Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды
Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Галогены. История открытия галогенов
Галогены. История открытия галогенов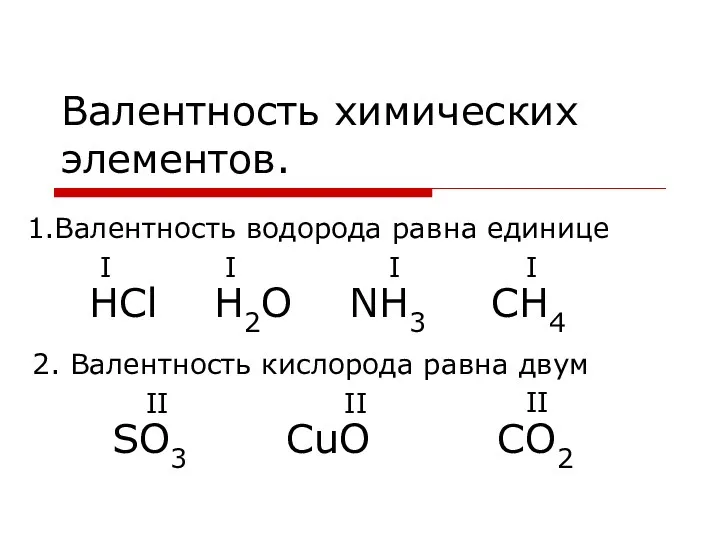 Валентность химических элементов
Валентность химических элементов Золото
Золото Перманганат калия
Перманганат калия Азот. Характеристика азота, фосфора (9класс)
Азот. Характеристика азота, фосфора (9класс) Катализ и катализаторы
Катализ и катализаторы Сполуки основних класів у будівництві і побуті
Сполуки основних класів у будівництві і побуті Метанол. Фізичні властивості
Метанол. Фізичні властивості Тепловой эффект химических реакций
Тепловой эффект химических реакций Получение и применение альдегидов
Получение и применение альдегидов Процесс электролиза
Процесс электролиза Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Фуллерен С60 и его аналоги
Фуллерен С60 и его аналоги Формы залегания метаморфических пород
Формы залегания метаморфических пород Цікаві факти про хімію
Цікаві факти про хімію Задачи на избыток-недостаток
Задачи на избыток-недостаток Розчин та його компоненти
Розчин та його компоненти Кристалічний і аморфний стани твердих речовин
Кристалічний і аморфний стани твердих речовин Межлабораторные сравнительные испытания качественных параметров нефтепродуктов
Межлабораторные сравнительные испытания качественных параметров нефтепродуктов