Содержание
- 2. Катализ – это явление изменения скорости реакции под влиянием ве-ществ, называемых катализаторами.
- 3. Катализаторы – это вещества, изменяющие скорость химической реак-ции, но не изменяющиеся в ходе процесса ни качествен-но,
- 4. Небольшие количества катализаторов способны существенно изменить скорость взаимодействия большого количества реагирующих веществ.
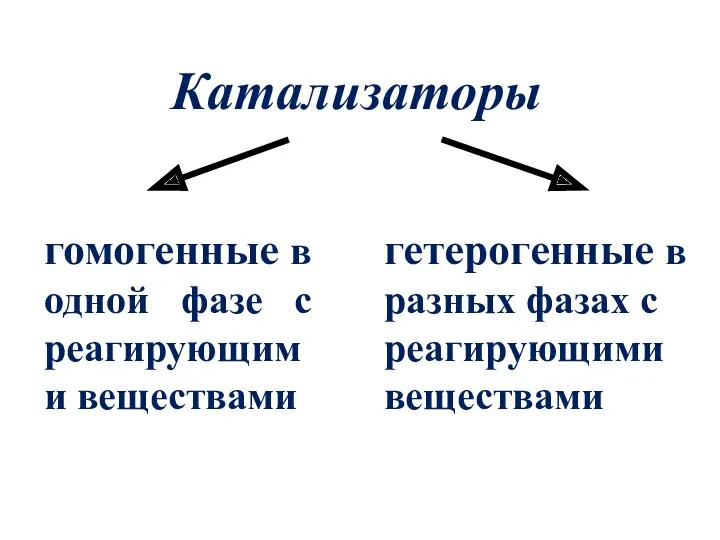
- 5. Катализаторы гомогенные в одной фазе с реагирующими веществами гетерогенные в разных фазах с реагирующими веществами
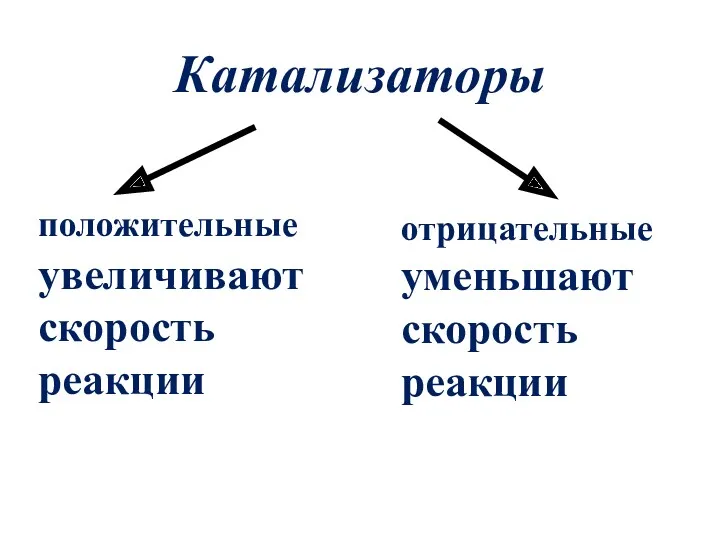
- 6. Катализаторы положительные увеличивают скорость реакции отрицательные уменьшают скорость реакции
- 7. Ингибаторы – вещества, уменьша-ющие скорость реакции, но расходую-щиеся при этом сами. С точки зрения теории активного
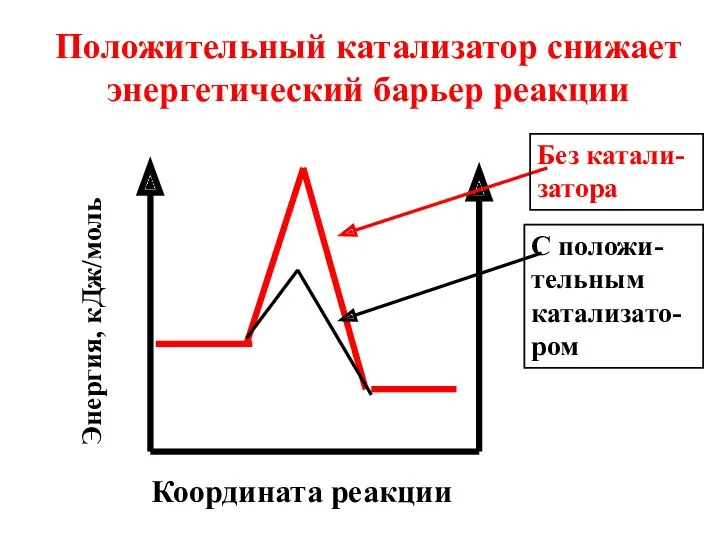
- 8. Координата реакции Положительный катализатор снижает энергетический барьер реакции Энергия, кДж/моль Без катали-затора С положи-тельным катализато-ром
- 9. Под воздействием положительного катализатора в реакционной смеси возрастает доля активных молекул при данной температуре. Скорость реакции
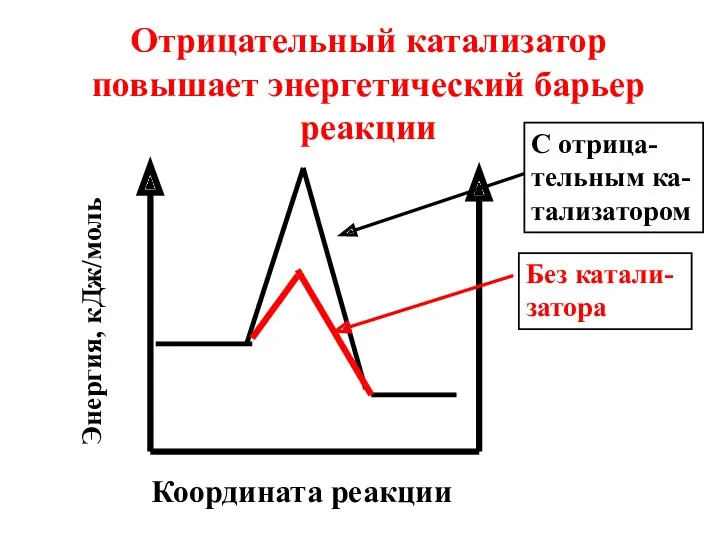
- 10. Координата реакции Отрицательный катализатор повышает энергетический барьер реакции Энергия, кДж/моль Без катали-затора С отрица-тельным ка-тализатором
- 11. Под воздействием отрицательного катализатора в реакционной смеси снижается доля активных молекул при данной температуре. Скорость реакции
- 12. Частным случаем катализа является автокатализ: катализатором служит один из продуктов реакции. Пример автокаталитической реакции: 2 KMnO4
- 13. Разрушение озонового слоя Земли – пример гомогенного катализа, протекающего в атмосфере под воздействием фреонов. Фреоны –
- 14. В атмосфере происходит разложение фреонов под воздействием ультрафиолетового излучения солнца: CF2Cl2 → CF2Cl• + Cl• Cl•
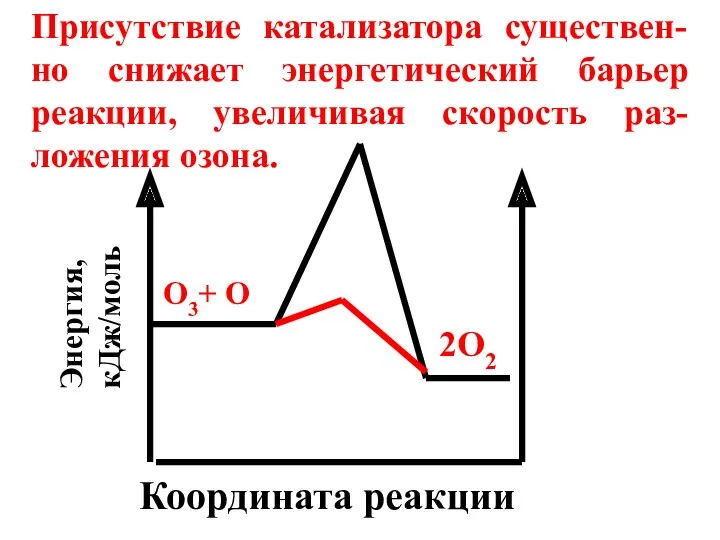
- 15. Без катализатора процесс протекает по схеме: O3 + O → 2 O2 Eак = 17,1 кДж/моль
- 16. В присутствии катализатора: O3 + Cl → ClO + O2 Eак= 2,1 кДж/моль ClO + O
- 17. Координата реакции Энергия, кДж/моль О3+ О 2О2 Присутствие катализатора существен-но снижает энергетический барьер реакции, увеличивая скорость
- 18. Практически все биохимические реакции являются ферментативными. Ферменты (биокатализаторы) – это вещества белковой природы, активированные катионами металлов.
- 19. Трипсин и химотрипсин – лечение бронхитов и пнев-монии; пепсин – лечение гастрита; плазмин – лечение инфаркта;
- 20. На активность ферментов оказывают влияние: а) температура, б) кислотность среды, в) наличие ингибиторов
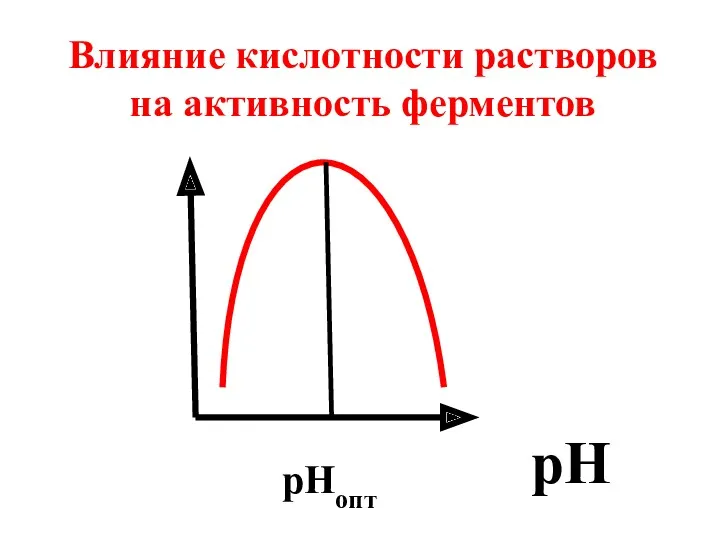
- 21. pH рНопт Влияние кислотности растворов на активность ферментов
- 22. Для большинства ферментов опти-мальные значения рН совпадают с физиологическими значениями (7,3-7,4). Однако существуют фер-менты, для нормального
- 23. Ингибиторы ферментов – это вещества, занимающие часть активных центров молекул фермента, в результате чего скорость ферментативной
- 25. Скачать презентацию
















 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)