Содержание
- 2. Домашнее задание: § 35, вопросы
- 4. Все вещества по их способности проводить электрический ток в растворах делятся на электролиты и неэлектролиты.
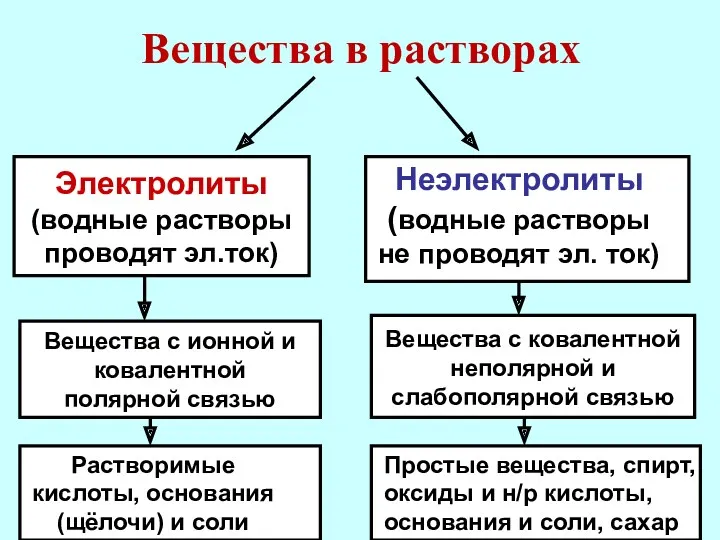
- 5. Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества
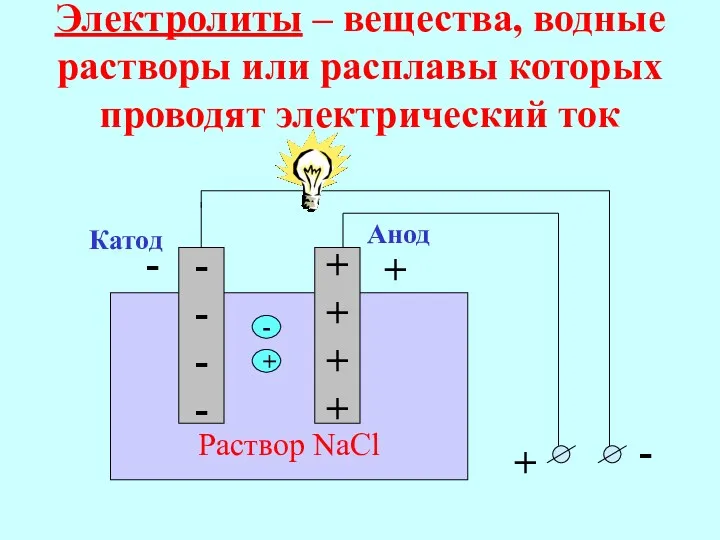
- 6. Электролиты – вещества, водные растворы или расплавы которых проводят электрический ток Раствор NaCl - - -
- 7. Неэлектролиты – вещества, водные растворы или расплавы которых не проводят электрический ток
- 8. Кислоты: HCl, H2SO4 Основания: NaOH, Ba(OH)2 Соли: NaCl, CuSO4 Органические вещества Газы: O2, H2, CO2 Оксиды:
- 9. Из предложенных веществ выпишите электролиты HCl NaCl Cl2 KOH H2SO4 SO2
- 10. Электролитическая диссоциация – процесс распада электролита на ионы при растворении в воде или расплавлении.
- 11. Теория электролитической диссоциации (ТЭД) В 1887г. Шведский учёный С. Аррениус для объяснения особенностей водных растворов веществ
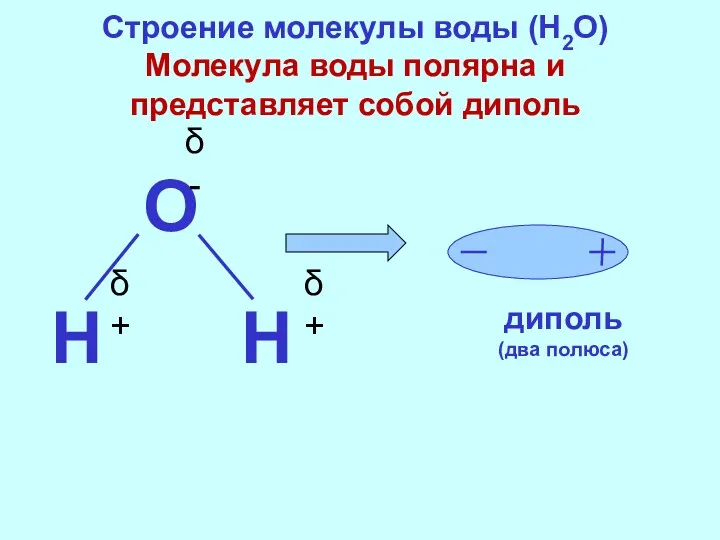
- 12. Строение молекулы воды (H2O) Молекула воды полярна и представляет собой диполь δ- δ+ δ+
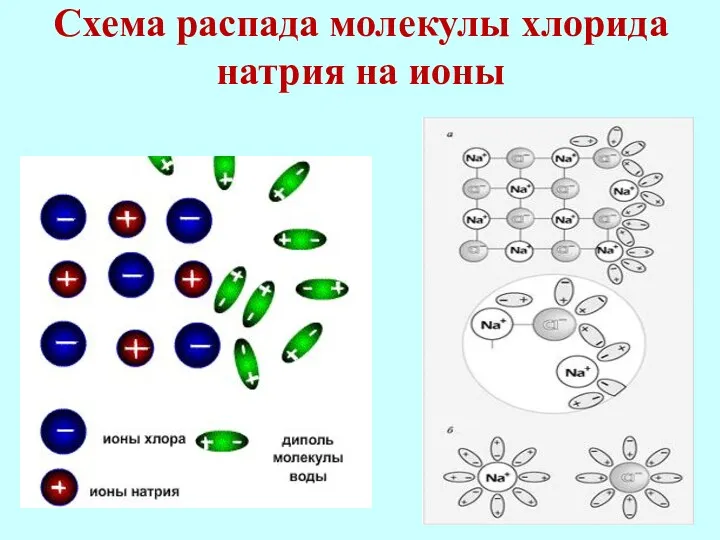
- 13. Схема распада молекулы хлорида натрия на ионы
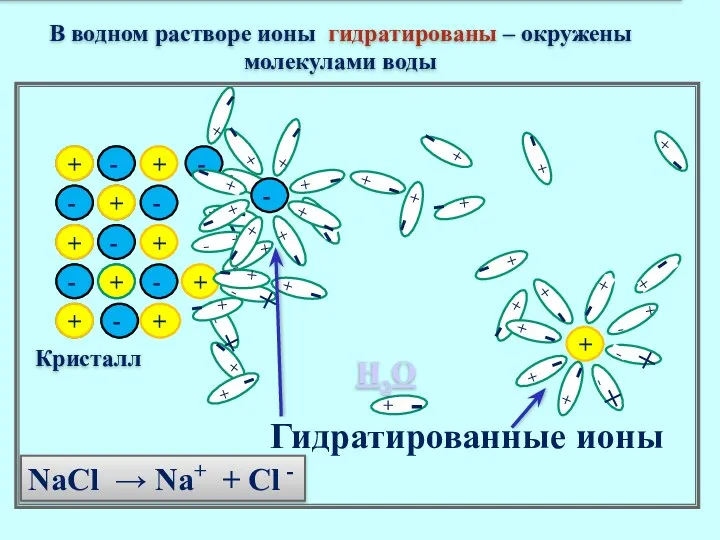
- 14. + + - - + + - - В водном растворе ионы гидратированы – окружены молекулами
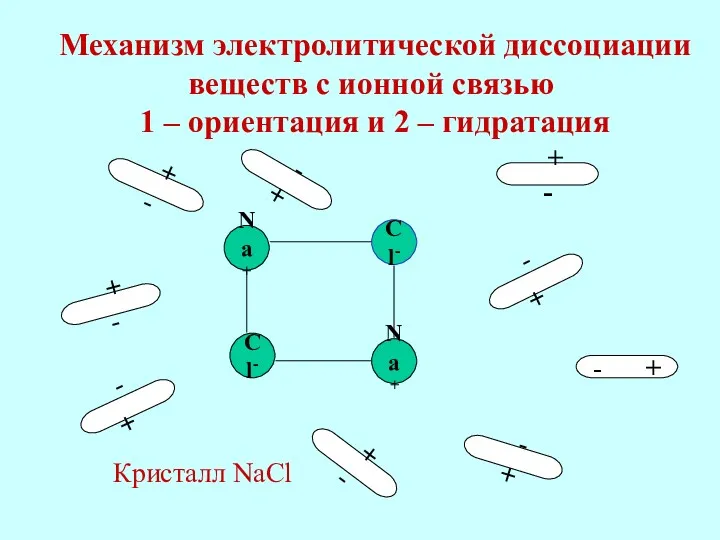
- 15. Na+ Cl- Cl- Na+ Механизм электролитической диссоциации веществ с ионной связью 1 – ориентация и 2
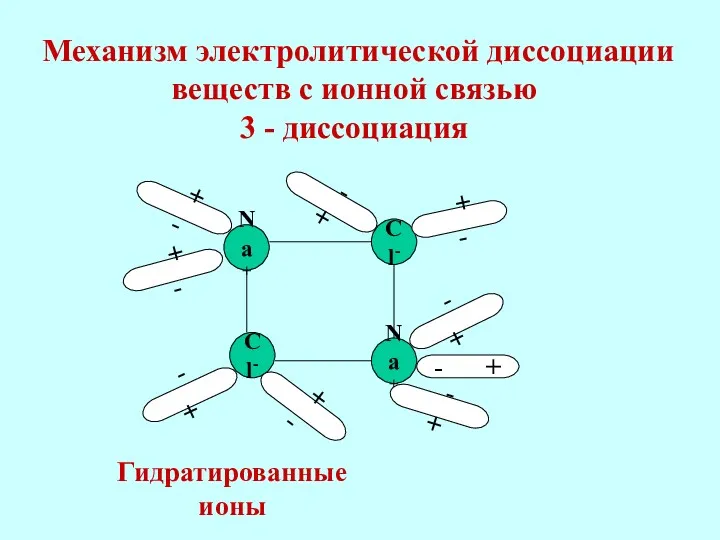
- 16. Na+ Cl- Cl- Na+ Механизм электролитической диссоциации веществ с ионной связью 3 - диссоциация + -
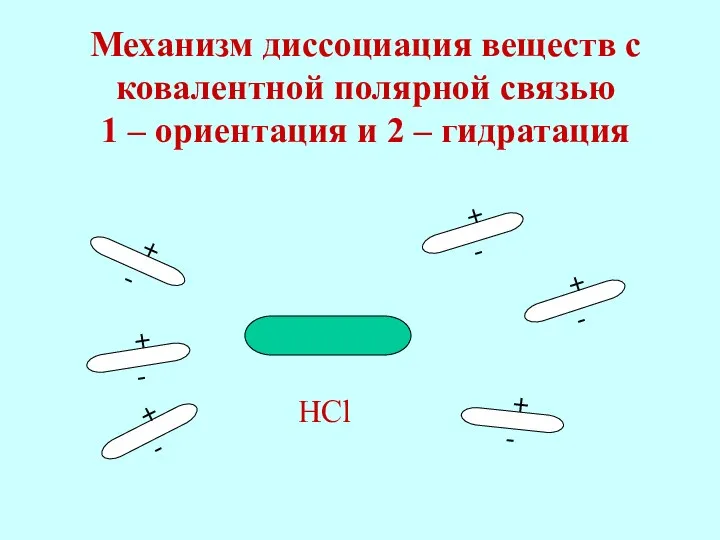
- 17. Механизм диссоциация веществ с ковалентной полярной связью 1 – ориентация и 2 – гидратация + -
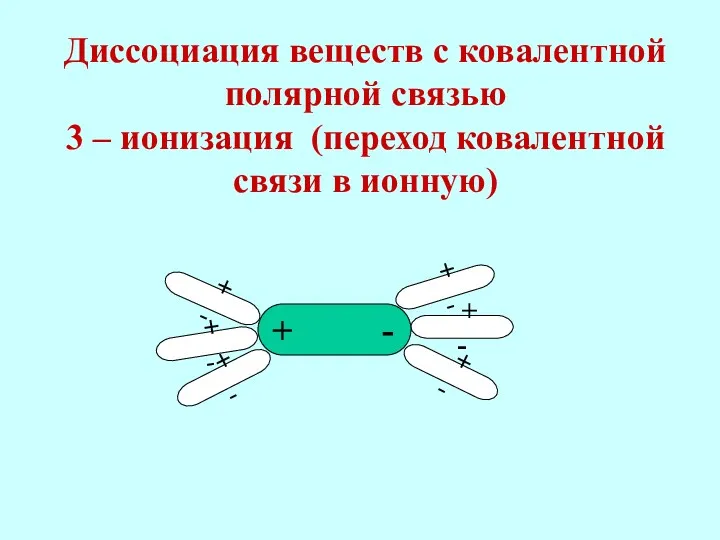
- 18. Диссоциация веществ с ковалентной полярной связью 3 – ионизация (переход ковалентной связи в ионную) + -
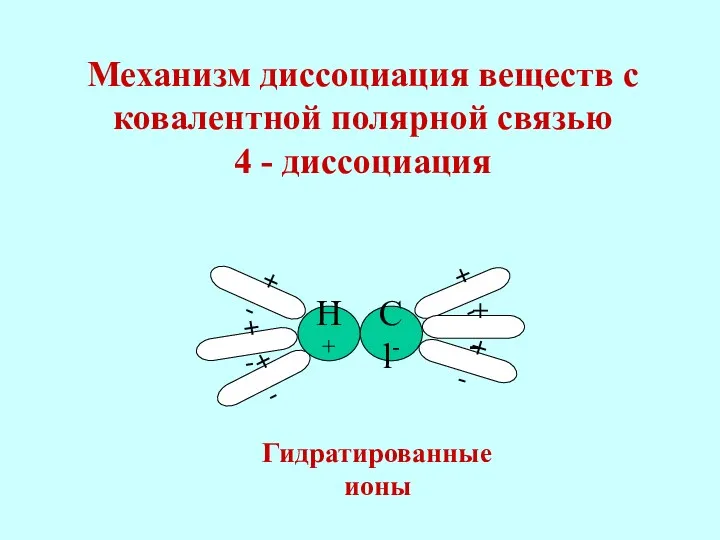
- 19. Механизм диссоциация веществ с ковалентной полярной связью 4 - диссоциация + - + - + -
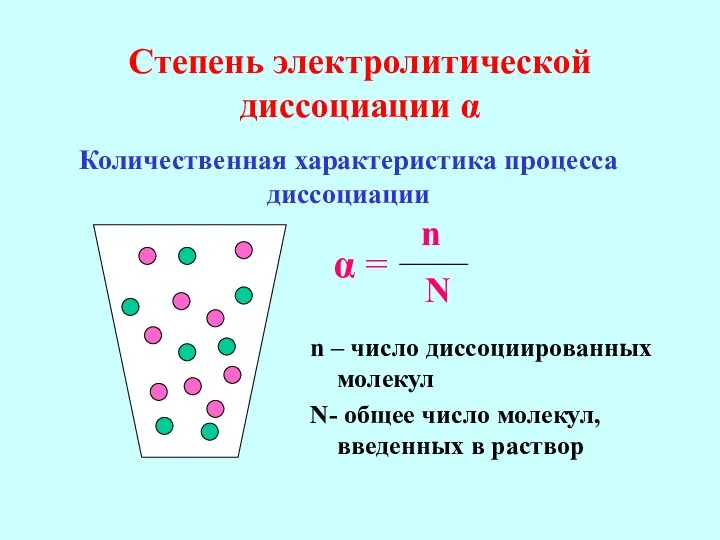
- 20. Степень электролитической диссоциации α n – число диссоциированных молекул N- общее число молекул, введенных в раствор
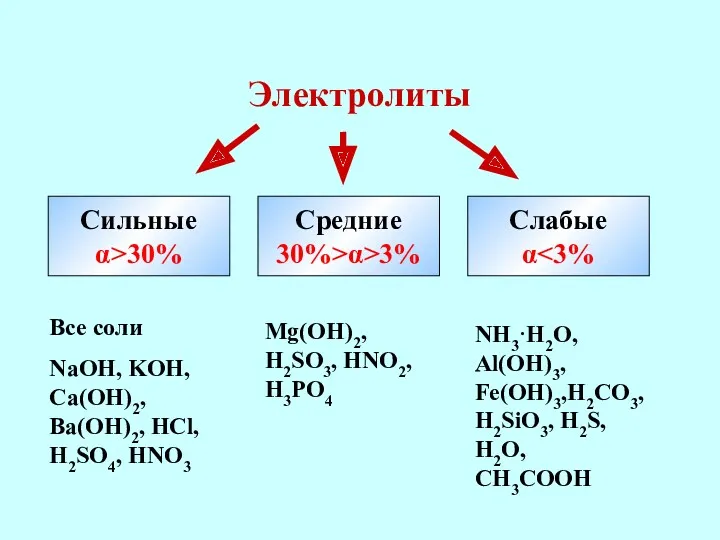
- 21. Электролиты Сильные α>30% Средние 30%>α>3% Слабые α Все соли NaOH, KOH, Ca(OH)2, Ba(OH)2, HCl, H2SO4, HNO3
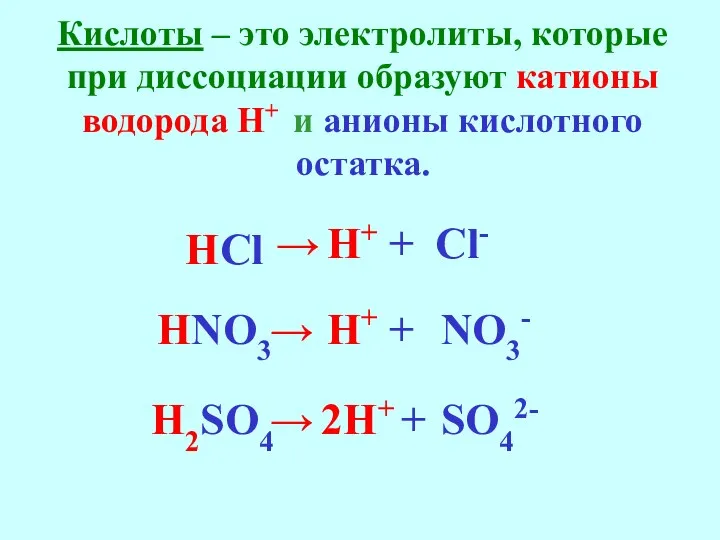
- 22. Кислоты – это электролиты, которые при диссоциации образуют катионы водорода Н+ и анионы кислотного остатка. H2SO4
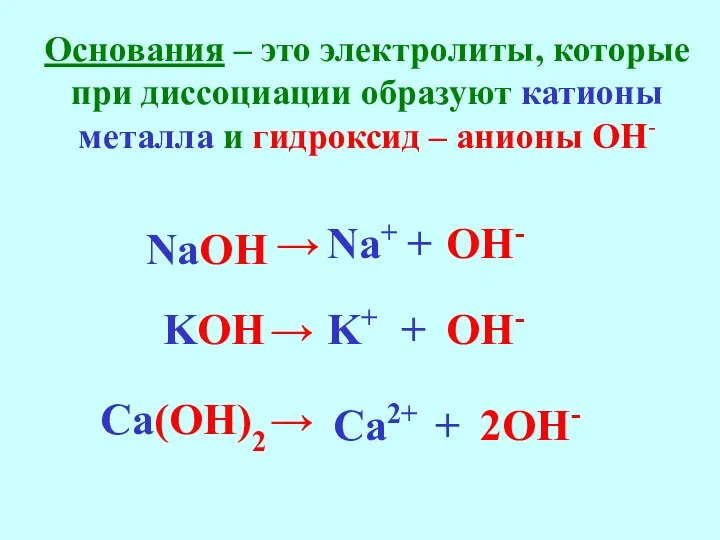
- 23. Основания – это электролиты, которые при диссоциации образуют катионы металла и гидроксид – анионы ОН- Ca(OH)2
- 24. Соли – это электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+ ) и анионы
- 25. Напишите уравнения диссоциации электролитов KNO3 NaOH Mg(NO2)2 H2SO4 Ba(OH)2 Fe2(SO4)3 HCl Na2SO4
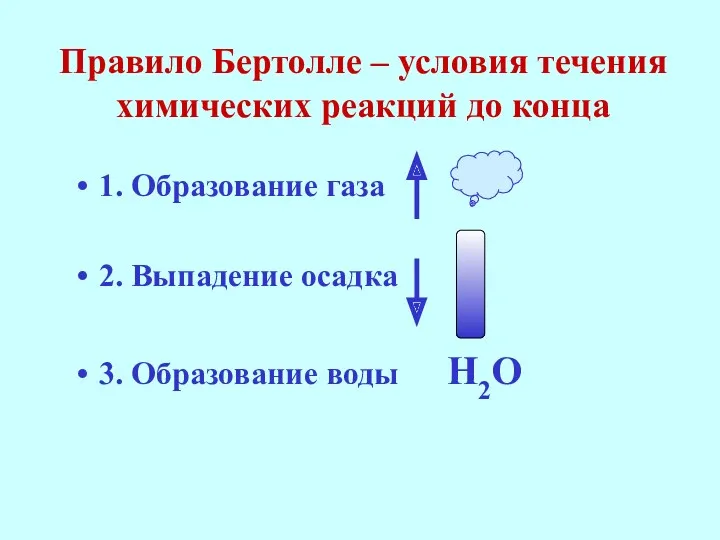
- 26. Правило Бертолле – условия течения химических реакций до конца 1. Образование газа 2. Выпадение осадка 3.
- 28. Скачать презентацию










 Физические свойства минералов
Физические свойства минералов Строение атома. 10 ен
Строение атома. 10 ен Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Химический элемент V группы: сурьма
Химический элемент V группы: сурьма Приёмы обращения с лабораторным оборудованием и основы техники безопасности
Приёмы обращения с лабораторным оборудованием и основы техники безопасности Титан және оның қорытпалары. Титаннан жасалған құралдар
Титан және оның қорытпалары. Титаннан жасалған құралдар Производство азотной кислоты
Производство азотной кислоты Electroanalytical Chemistry
Electroanalytical Chemistry Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Crystal structure and surface phase composition of palladium oxides thin films for gas sensors
Crystal structure and surface phase composition of palladium oxides thin films for gas sensors Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы. Лекция 8
Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы. Лекция 8 Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Химическая связь
Химическая связь Мир запахов
Мир запахов Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Молекулярно-массовые характеристики высокомолекулярных соединений
Молекулярно-массовые характеристики высокомолекулярных соединений Предельные углеводороды. (9 класс)
Предельные углеводороды. (9 класс) Механизм и закономерности кристаллизации металлов
Механизм и закономерности кристаллизации металлов Молекулярно-кинетические свойства дисперсных систем
Молекулярно-кинетические свойства дисперсных систем Оксиды(1)
Оксиды(1) Коррозия металлов
Коррозия металлов Калийные Удобрения
Калийные Удобрения Производные хинолина и хинуклидина, производные 4-замещенных хинолина
Производные хинолина и хинуклидина, производные 4-замещенных хинолина Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы