Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы. Лекция 8 презентация
Содержание
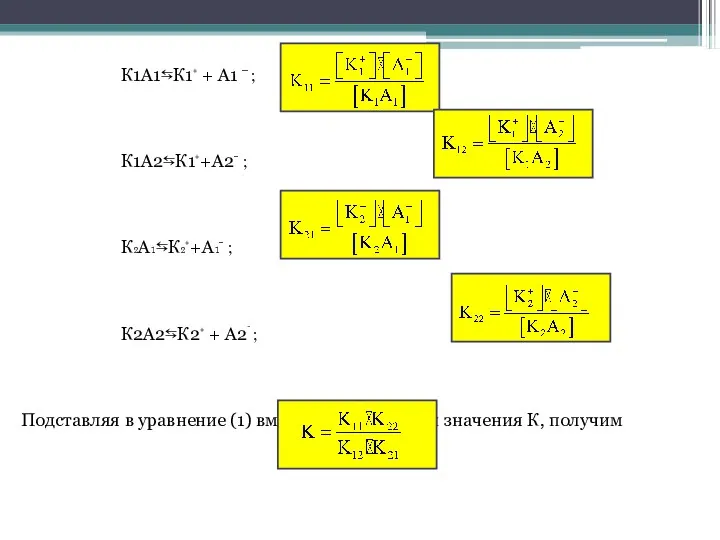
- 2. К1А1⇆К1⁺ + А1 − ; К1А2⇆К1⁺+А2⁻ ; К₂А₁⇆К₂⁺+А₁⁻ ; К2А2⇆К2⁺ + А2⁻ ; Подставляя в уравнение
- 3. Если К>1, т.е. К₁₁· К₂₂ > К₁₂·К₂₁, то равновесие смещено вправо (легче идёт прямая реакция). Если
- 4. В виде ионов записывают формулы: сильных кислот (HClO4, H2SO4, HNO3, HI и др.); сильных оснований (щелочей
- 5. В виде молекул записывают формулы: воды; слабых кислот (HNO2, HCN, H2CO3, H2SO3, CH3COOH и др.); слабых
- 6. Реакции обмена в растворах принято изображать тремя уравнениями: NaOH + HСl = NaCl + H2O –
- 7. Составим молекулярное и ионное уравнения реакции между нитратом серебра (I) и хлоридом натрия: AgNO3 + NaCl
- 8. Составим молекулярное и ионное уравнения реакции нейтрализации между растворами гидроксида натрия и серной кислоты: 2NaOH +
- 9. Составим молекулярное и ионное уравнения реакции между растворами гидроксида кальция и хлорида аммония: Ca(OH)2 + 2NH4Cl
- 10. 4. Реакции, протекающие с образованием комплексного иона Составим молекулярное и ионное уравнения реакции между растворами йодида
- 11. Если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т.е.
- 12. Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих
- 13. Ионное произведение воды Вода является слабым электролитом, который диссоциирует на ионы: H₂O ⇄ H⁺ + OH⁻
- 14. Ионное произведение воды – постоянная величина, как для чистой воды, так и водных растворов различных электролитов,
- 15. Водородный показатель По кислотно-основным свойствам растворы обычно делят на кислые, нейтральные и щелочные. Это лишь качественная
- 16. Расчет рН в растворах сильных и слабых кислот 1. Поскольку диссоциация сильной кислоты (HNO3, HCl, H2SO4,
- 17. Расчет рН в растворах сильных и слабых оснований 1. Диссоциация сильного основания (LiOH, NaOH, KOH, RbOH,
- 18. Пример. Считая диссоциацию гидроксида калия в воде полной, вычислите PН 0,001 М раствора KOH. Решение. Определяем
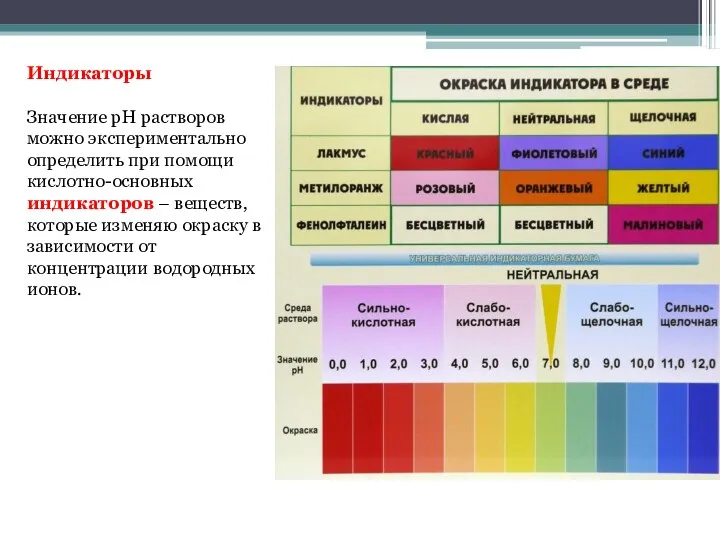
- 19. Индикаторы Значение pH растворов можно экспериментально определить при помощи кислотно-основных индикаторов – веществ, которые изменяю окраску
- 20. Каждый индикатор характеризуется определёнными интервалами pH раствора, при которых он изменяет свой цвет. Изменение цвета лакмуса
- 22. Скачать презентацию

















 Щелочные металлы
Щелочные металлы Аллотропные модификации углерода. Алмазы
Аллотропные модификации углерода. Алмазы Закон сохранения массы веществ. Уравнения химических реакций
Закон сохранения массы веществ. Уравнения химических реакций Различные теории кислот и оснований
Различные теории кислот и оснований Қышқылды-сілтілі тепетеңдік бұзылысының клиникалық биохимиясы
Қышқылды-сілтілі тепетеңдік бұзылысының клиникалық биохимиясы Параметры токсичности продуктов горения материала. (Задача 3)
Параметры токсичности продуктов горения материала. (Задача 3) Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Натуральный каучук
Натуральный каучук Валентность химического элемента. Определение валентности по химической формуле
Валентность химического элемента. Определение валентности по химической формуле Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Основные сведения о строении металлов и теории сплавов
Основные сведения о строении металлов и теории сплавов Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Магматизм. (Лекция 6)
Магматизм. (Лекция 6) Типы химических реакций
Типы химических реакций Углерод и его соединения
Углерод и его соединения Растворы. Лекция №5
Растворы. Лекция №5 Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Si - Silicon. Distribute Properties
Si - Silicon. Distribute Properties Непредельные углеводороды
Непредельные углеводороды Калийные удобрения
Калийные удобрения Химия нефти и газа. Переработка нефти
Химия нефти и газа. Переработка нефти Electrolysis
Electrolysis Минералогия. Формы нахождения минералов в природе. Свойства минералов
Минералогия. Формы нахождения минералов в природе. Свойства минералов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)
Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13) Твёрдое агрегатное состояние. Кристалические решетки. Урок 4
Твёрдое агрегатное состояние. Кристалические решетки. Урок 4