Содержание
- 2. скисание молока, подгорание пищи на сковороде, испарение жидкой ртути, почернение серебряных изделий, образование тумана, испарение воды,
- 3. Условия хим.реакций Соприкосновение, измельчение или перемешивание Нагревание (t) Увеличение или уменьшение давления(p) (вакуум) Облучение (hv) Электрический
- 4. Выделяется газ Выпадет осадок Происходит изменение окраски веществ Выделяется или поглощается тепло, свет Появление запаха (иногда
- 5. Химический знак Химическая формула Атом Молекула Коэффициент Индекс Химическая реакция Основные понятия для повторения
- 6. Химическими реакциями называются явления, в процессе которых происходит образование новых веществ – продуктов реакции называются явления,
- 7. Закон сохранения массы веществ Уравнение химической реакции Реагенты Продукты Новые понятия
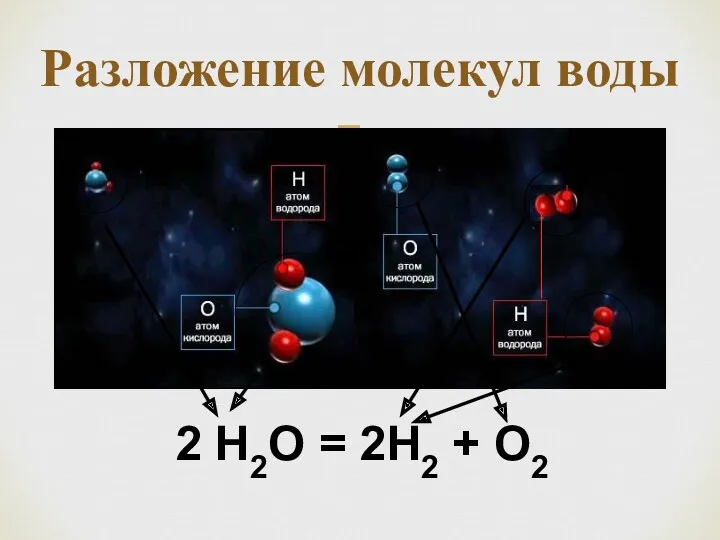
- 8. Разложение молекул воды 2 Н2О = 2Н2 + О2
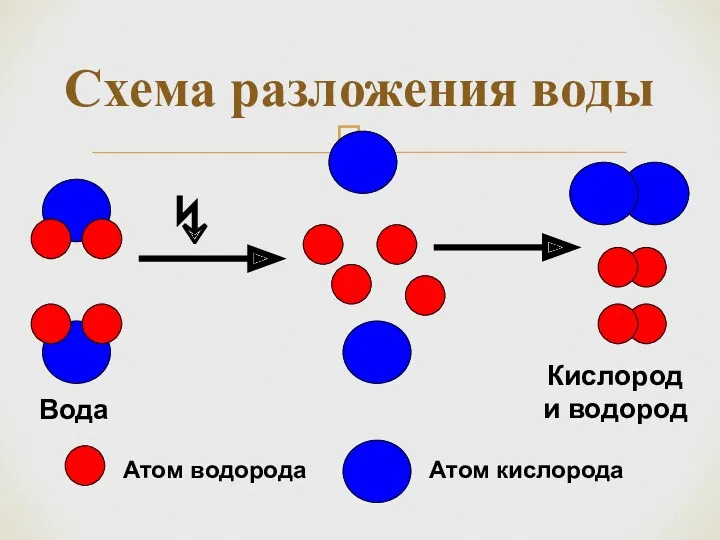
- 9. Схема разложения воды Атом водорода Атом кислорода ↯ Вода Кислород и водород
- 10. При химических явлениях происходит разрушение молекул исходных веществ и образование новых молекул из тех же атомов,
- 11. Формулировка закона сохранения массы веществ Масса веществ, получившихся в результате реакции Число атомов каждого элемента должно
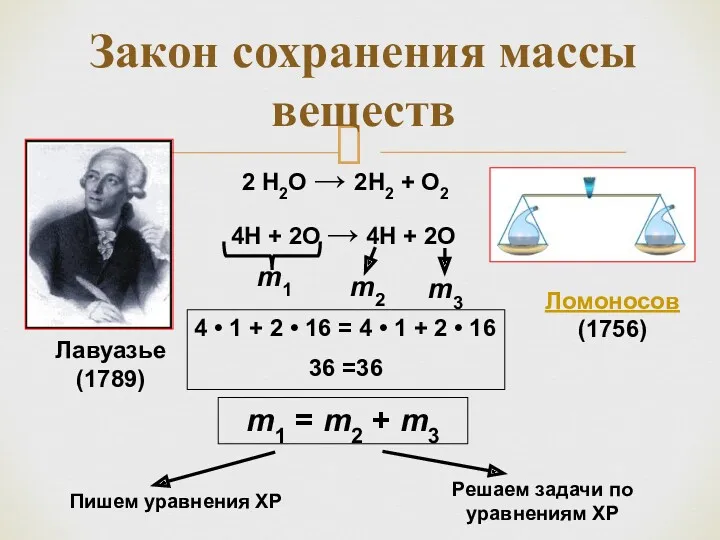
- 12. Закон сохранения массы веществ 2 Н2О → 2Н2 + О2 4Н + 2О → 4Н +
- 13. Михаил Васильевич Ломоносов (1711 – 1765) Родился в 1711 году в России Русский ученый – природо-вед
- 14. Способствует дальнейшему развитию химии Позволяет производить важные вычисления стр 39 На основе данного закона составляют уравнения
- 15. Медь соединяется с серой в массовом отношении 2:1. Для приготовления 21г сульфида меди (II) сколько потребуется
- 16. Метан, сгорая в кислороде, образует углекислый газ и воду. Можно ли сократить запись? Можно ли сделать
- 17. Давайте подчеркнём в исходной фразе названия веществ. Метан сгорая в кислороде образует углекислый газ и воду.
- 18. Этого недостаточно. Остались слова, которые тоже требуют замены. Метан, сгорая в кислороде, образует углекислый газ и
- 19. Язык науки математики сгорая в означает «взаимодействует» – «+» образует означает «получается» – «=» и –
- 20. Метан, СН4 сгорая в + кислороде, О2 образует = углекислый газ СО2 и + воду Н2О
- 21. СН4 + О2 = СО2 + Н2О Мr(СН4 ) = 12 + 4*1 = 16 Mr(О2
- 22. СН4 + 2О2 = СО2 + 2Н2О Полученная нами краткая запись химической реакции называется уравнением химической
- 23. Уравнением химической реакции называют условную запись химической реакции с помощью химических формул, коэффициентов и математических знаков.
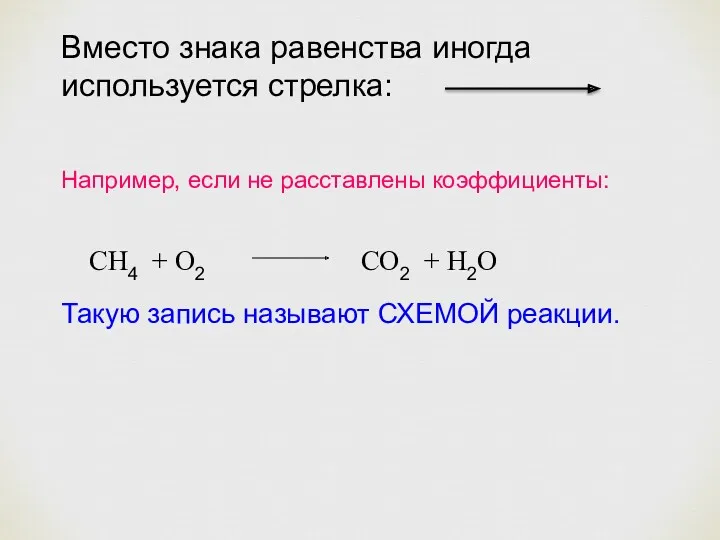
- 24. Вместо знака равенства иногда используется стрелка: Например, если не расставлены коэффициенты: СН4 + О2 СО2 +
- 25. На основе услышанного составьте уравнение реакции
- 26. Красный фосфор энергично сгорает в кислороде. Подожжем порошок фосфора и опустим в колбу с кислородом. В
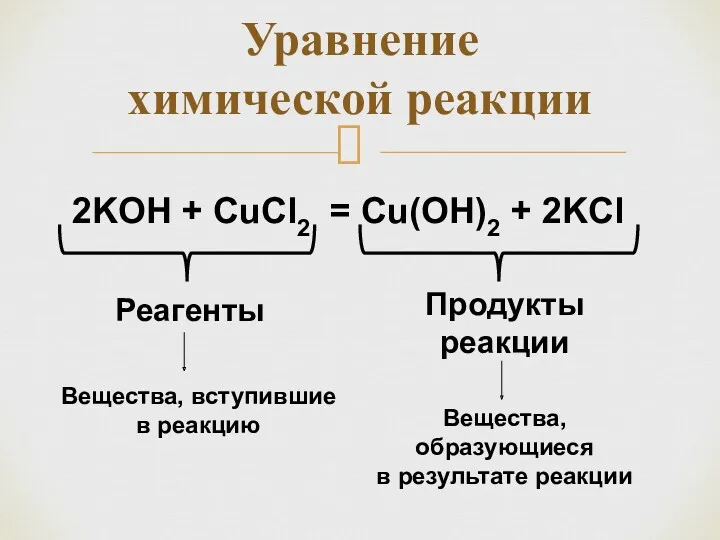
- 27. Уравнение химической реакции 2KOH + CuCl2 = Cu(OH)2 + 2KCl Реагенты Продукты реакции Вещества, вступившие в
- 28. Запишите названия исходных веществ и продуктов реакции для следующих уравнений химических реакций: а) Fe + S
- 29. Алгоритм составления уравнений химических реакций В левой части записываются формулы веществ, которые вступают в реакцию: В
- 30. Расстановку коэффициентов начинают с элемента, чьих атомов в реакции участвует больше. Количество атомов кислорода до и
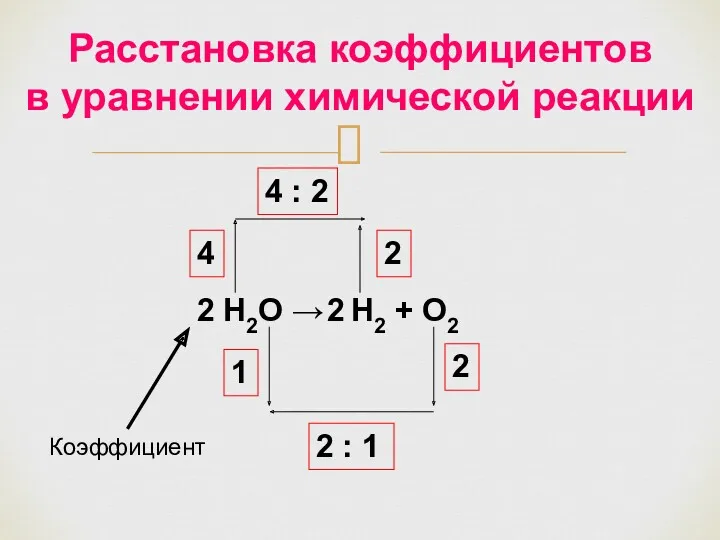
- 31. Н2О → Н2 + О2 Расстановка коэффициентов в уравнении химической реакции 4 4 : 2 2
- 32. Какие вещества вступают в реакцию. Какие вещества образуются в результате реакции. Массу реагирующих веществ и веществ,
- 33. Расставьте коэффициенты в уравнениях реакции. 1. Cu + O2 → CuO 2. HCl → H2 +Cl2
- 34. Домашнее задание Расставьте коэффициенты в следующих урав-нениях химических реакций: N2 + H2 → NH3, MnO2 +
- 35. Домашнее задание При взаимодействии цинка массой 65 г с серой образовался сульфид цинка (ZnS) массой 97
- 36. Составьте уравнения реакций по названию веществ. Расставьте коэффициенты. Цинк + хлорид водорода = хлорид цинка +
- 37. Формула воды – Н2О Кальций – метал Фосфор – металл Сложное вещество состоит из разных веществ
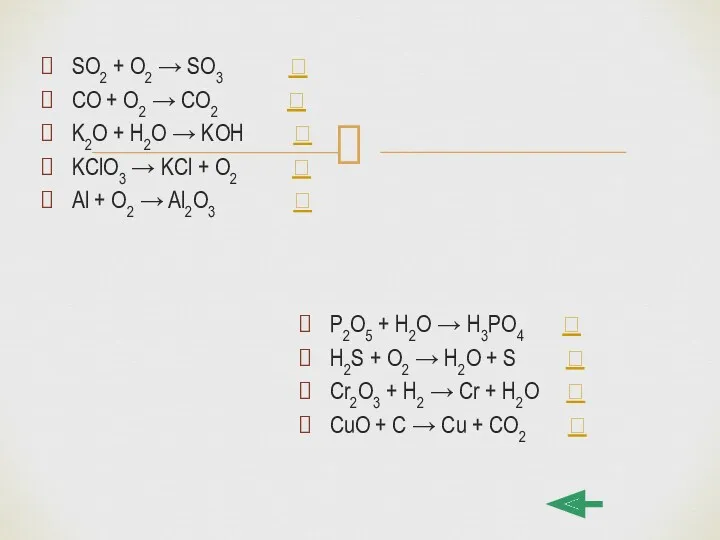
- 38. SO2 + O2 → SO3 CO + O2 → CO2 K2O + H2O →
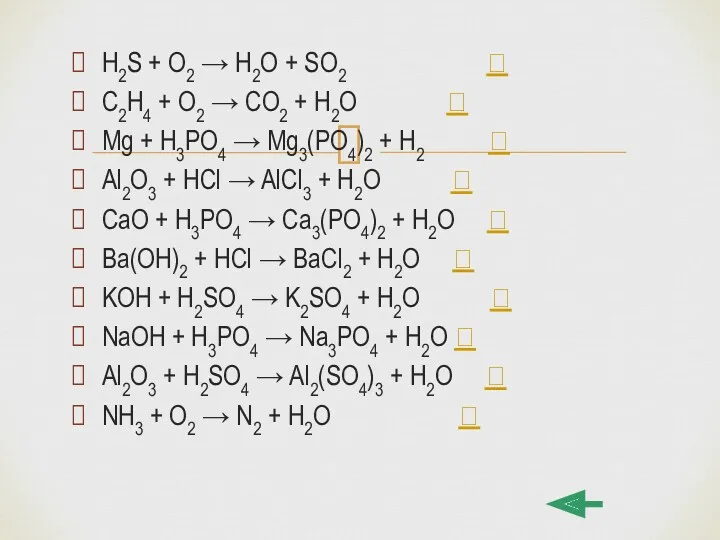
- 39. H2S + O2 → H2O + SO2 C2H4 + O2 → CO2 + H2O
- 41. Скачать презентацию





























 Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов
Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов Ионные уравнения реакций
Ионные уравнения реакций Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары
Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Водород. Свойства водорода
Водород. Свойства водорода Периодическая система химических элементов Д.И.Менделеева
Периодическая система химических элементов Д.И.Менделеева Химический состав клетки
Химический состав клетки Лекция 4. Физико-химические свойства растворов
Лекция 4. Физико-химические свойства растворов Відносна молекулярна маса
Відносна молекулярна маса Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Электролиз. 11 класс
Электролиз. 11 класс ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Химические элементы в космосе. Космогеохимия
Химические элементы в космосе. Космогеохимия Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Вирощування кристалів в додомашніх умовах
Вирощування кристалів в додомашніх умовах Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Алкины. Тема 4
Алкины. Тема 4 Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Сhemistry in English and chemical elements in English
Сhemistry in English and chemical elements in English Металлические стёкла
Металлические стёкла Галогены. Элементы VII группы
Галогены. Элементы VII группы Антибиотики пенициллинового ряда
Антибиотики пенициллинового ряда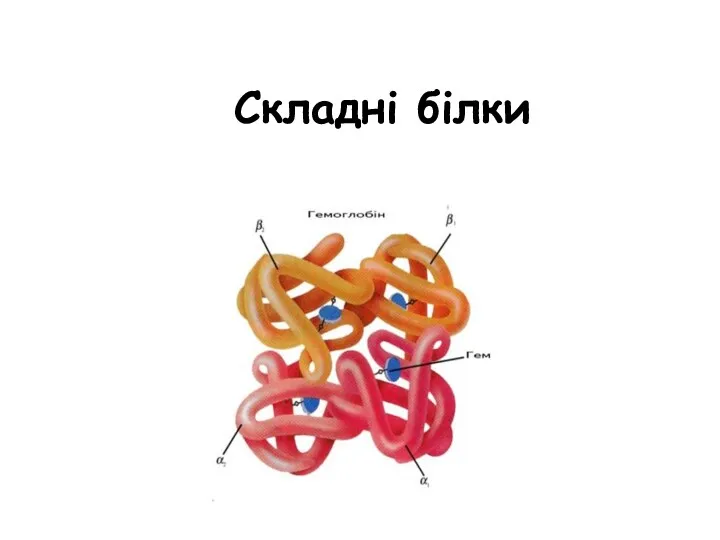 Складні білки
Складні білки