Содержание
- 2. КОНСУЛЬТАЦИЯ: 11 января 2017 г. в К2 в 16-00 ЭКЗАМЕН (в K2 в 9-00) ХЕБО-13-16 13
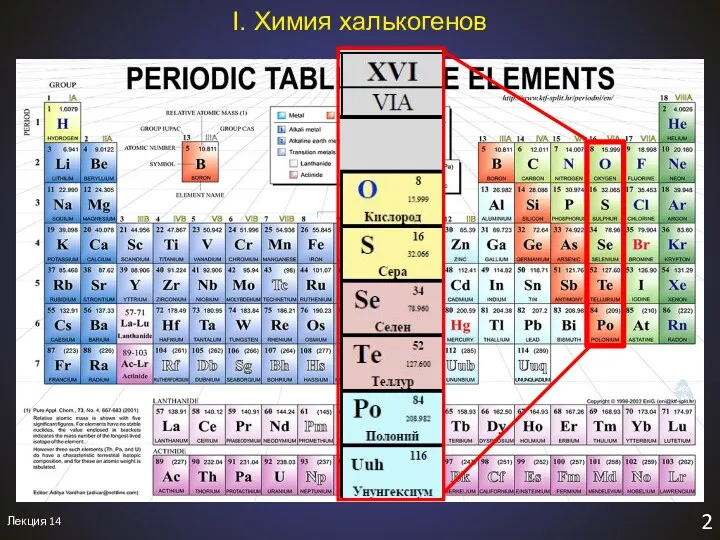
- 3. ПЛАН ЛЕКЦИИ Химия элементов VIA-группы. 1. Общая характеристика халькогенов. Свойства простых веществ. 2. Соединения халькогенов с
- 4. Ливерморий Polonium - Польша Халькогены – «рождающие руду» χαλκος - руда γεννάω - рождать ύξός –
- 5. Лекция 14 3 I. Халькогены. Общая характеристика 1. Общая характеристика элементов 1.1. Строение атома (электронное). 1.2
- 6. Лекция 14 4 II. Химия халькогенов. Общая характеристика 1.1. Строение атома (валентные подуровни). XVI (VIA) O,
- 7. Лекция 14 5 1.2. Физико-химические свойства простых веществ II. Химия халькогенов. Общая характеристика S8 tпл =
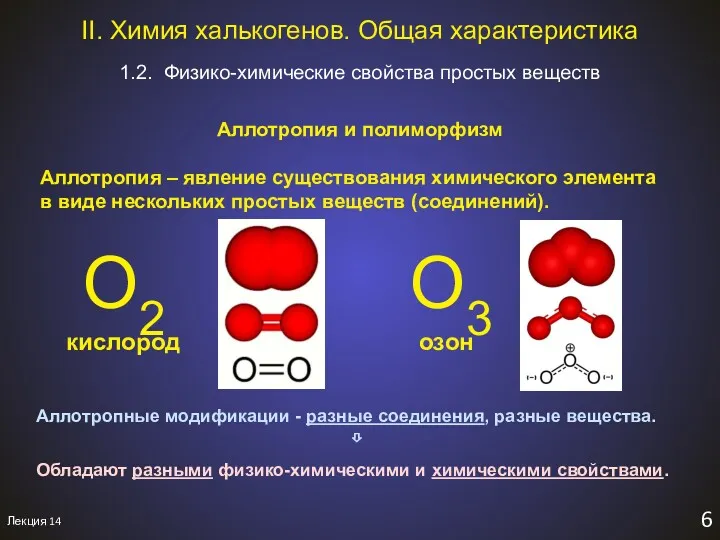
- 8. Лекция 14 6 1.2. Физико-химические свойства простых веществ II. Химия халькогенов. Общая характеристика Aллотропия и полиморфизм
- 9. Лекция 14 7 Полиморфизм – явление существования одного соединения в виде двух или более веществ с
- 10. Лекция 14 8 1.2. Физико-химические свойства простых веществ II. Химия халькогенов. Общая характеристика Aллотропия и полиморфизм
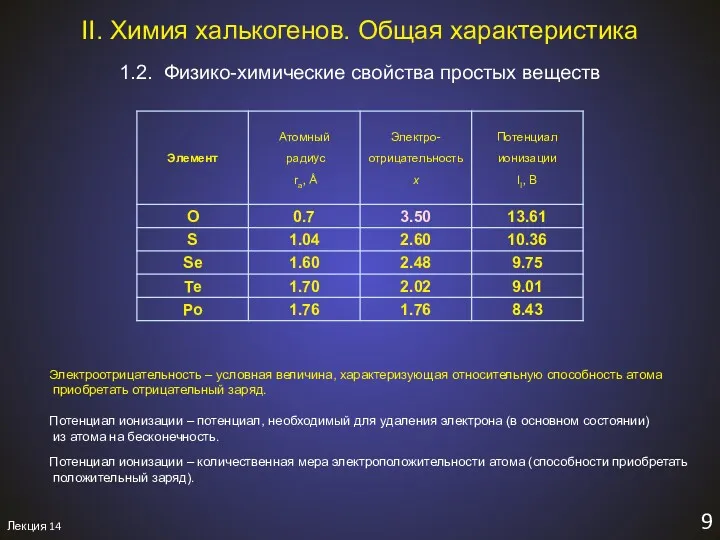
- 11. Лекция 14 9 1.2. Физико-химические свойства простых веществ II. Химия халькогенов. Общая характеристика Электроотрицательность – условная
- 12. Лекция 14 10 II. Химия халькогенов. Общая характеристика 1.3. Химические свойства, общие для всех элементов групп
- 13. Лекция 3 11 В). Кислотные свойства растворов халькогеноводородов (S, Se, Te) H2Э + H2O ⮀ HЭ-
- 14. 2 период: очень маленький размер атомов, отсутствие d-орбиталей сверху вниз по группе усиливаются восстановительные свойства Лекция
- 15. Лекция 3 13 1.4. Различия в химических свойствах халькогенов II. Химия халькогенов. Общая характеристика A). Очень
- 16. Лекция 14 14 1.4. Различия в химических свойствах халькогенов II. Химия халькогенов. Общая характеристика Б). Увеличение
- 17. Лекция 14 15 1.5. Химические свойства простых веществ II. Химия халькогенов. Общая характеристика А). С водой
- 18. Лекция 14 16 1.6. Нахождение в природе II. Химия халькогенов. Общая характеристика КИСЛОРОД: 47.2% – самый
- 19. Лекция 14 17 1.6. Нахождение в природе II. Химия халькогенов. Общая характеристика СЕРА: 0.05% Встречается в
- 20. Лекция 14 18 1.6. Нахождение в природе II. Химия халькогенов. Общая характеристика СЕЛЕН: 6.0·10-5 %, редкий
- 21. Лекция 14 19 1.6. Получение II. Химия халькогенов. Общая характеристика
- 22. Лекция 14 20 O3: впервые получен Шёнбейном в 1840 г. öζω - пахну Современные методы получения:
- 23. Лекция 14 21 1.6. Получение II. Химия халькогенов. Общая характеристика S8 известна с древнейших времён. Современные
- 24. Лекция 14 22 1.6. Получение II. Химия халькогенов. Общая характеристика Se: открыт Йёнсом Якобом Берцелиусом в
- 25. Лекция 3 23 1.6. Получение II. Химия халькогенов. Общая характеристика Po: открыт Марией Склодовской-Кюри и Пьером
- 26. Лекция 14 24 1.7. Применение II. Химия галогенов. Общая характеристика O: ● дыхание растений и животных
- 27. Лекция 14 25 II. Химия халькогенов. Водородные соединения 1.1. Халькогеноводороды. A. Строение. O-II [He]2s22p6 донор H+I
- 28. Лекция 14 26 II. Химия халькогенов. Водородные соединения Б. Физико-химические свойства. Причина немонотонности- водородные связи между
- 29. H2S 1. Промышленный методы: побочный продукт очистки нефти, природных и промышленных газов 2. Лабораторные методы: FeS2
- 30. Лекция 14 28 В. Химические свойства. I. Химия халькогенов. Водородные соединения 1) .Протолиз: H2Э + H2O
- 31. Лекция 14 29 В. Химические свойства (продолжение). II. Химия халькогенов. Водородные соединения 2). Сильные восстановительные свойства
- 32. Лекция 14 30 II. Химия халькогенов. Сульфиды. 1.2. Сульфиды А. Получение Fe + S = FeS
- 33. Лекция 14 31 II. Химия халькогенов. Сульфиды. 1.2. Сульфиды Задача 1. Рассчитайте молярную концентрацию сероводорода в
- 34. Лекция 14 32 II. Химия халькогенов. Сульфиды. В. Гидролиз Обратимый гидролиз: Na2S = 2Na+ + S2-
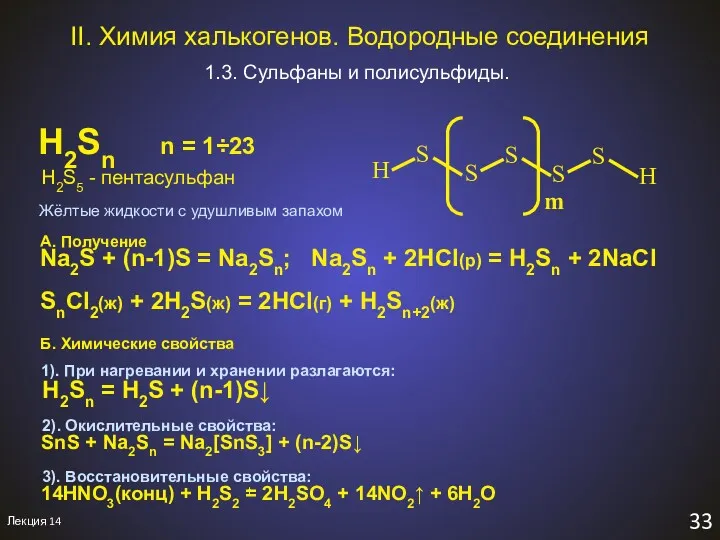
- 35. Лекция 14 33 II. Химия халькогенов. Водородные соединения 1.3. Сульфаны и полисульфиды. H2Sn n = 1÷23
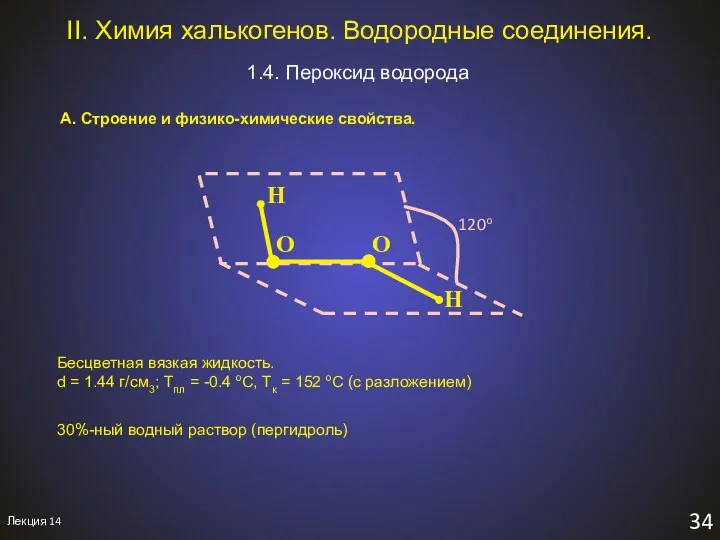
- 36. Лекция 14 34 II. Химия халькогенов. Водородные соединения. 1.4. Пероксид водорода A. Строение и физико-химические свойства.
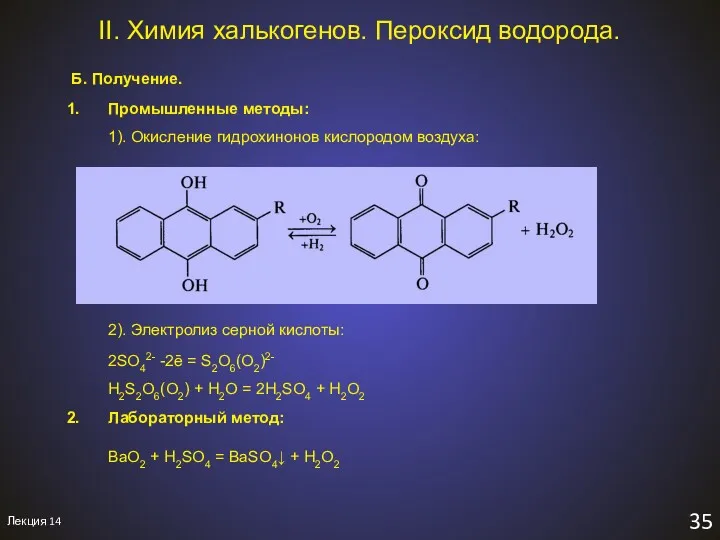
- 37. Лекция 14 35 II. Химия халькогенов. Пероксид водорода. Б. Получение. Промышленные методы: 1). Окисление гидрохинонов кислородом
- 38. Лекция 14 36 II. Химия халькогенов. Пероксид водорода. В. Химические свойства. 2). Окислительные свойства: 3). Восстановительные
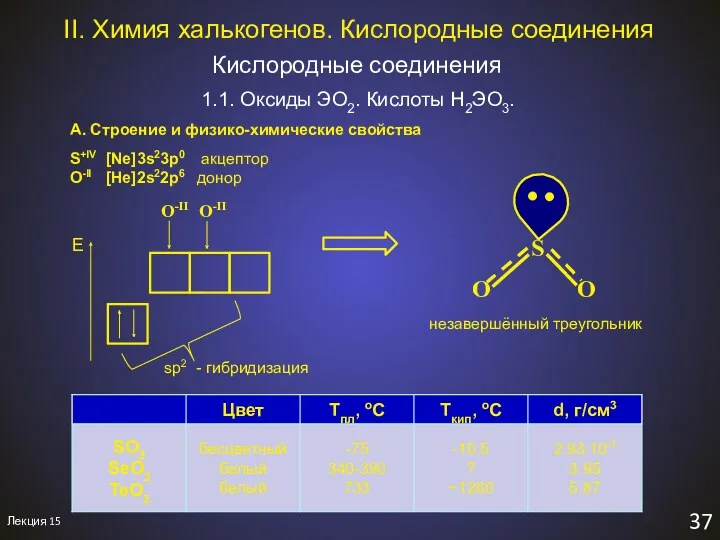
- 39. Лекция 15 37 II. Химия халькогенов. Кислородные соединения Кислородные соединения 1.1. Оксиды ЭO2. Кислоты H2ЭO3. А.
- 40. Лекция 3 37 Б. Получение II. Химия халькогенов. Оксиды ЭO2 t t
- 41. Лекция 2 38 В. Химические свойства 1). Взаимодействие с водой: SO2 + H2O ⮀ SO2∙H2O SO2
- 42. Лекция 3 39 Строение сульфит- и гидросульфит-ионов II. Химия халькогенов. Оксиды ЭO2 S+IV [Ne]3s23p0 акцептор O-II
- 43. Лекция 3 40 В. Химические свойства (продолжение) 3). Восстановительные свойства: II. Химия халькогенов. Оксиды ЭO2 5SO2
- 44. Лекция 3 41 II. Химия халькогенов. Кислородные соединения 1.2. Оксиды ЭO3 S+VI [Ne]3s03p0 акцептор O-II [He]2s22p6
- 45. Лекция 3 42 II. Химия халькогенов. Оксиды ЭO3 Б. Получение 1. В промышленности: 2SO2(г) + O2(г)
- 46. Лекция 3 43 II. Химия халькогенов. Оксиды ЭO3 В. Химические свойства 2). Взаимодействие с водой: SO3
- 47. Лекция 3 44 II. Химия халькогенов. Оксиды ЭO3 В. Химические свойства (продолжение) 3). Кислотные свойства: SO3
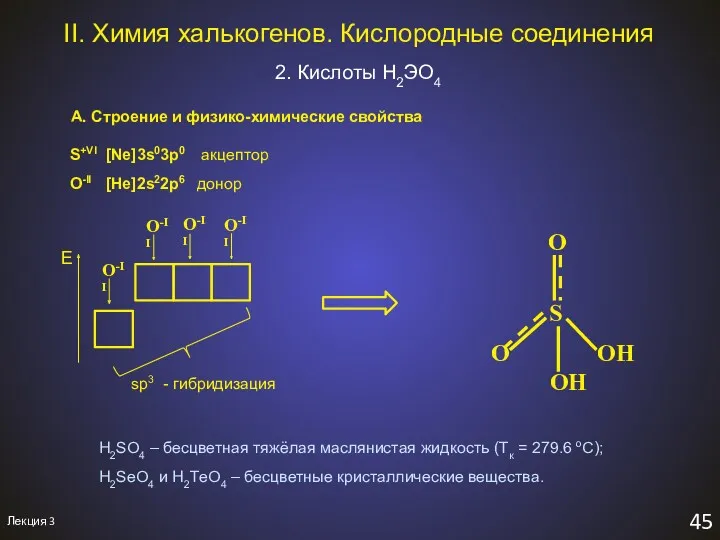
- 48. Лекция 3 45 II. Химия халькогенов. Кислородные соединения 2. Кислоты H2ЭO4 А. Строение и физико-химические свойства
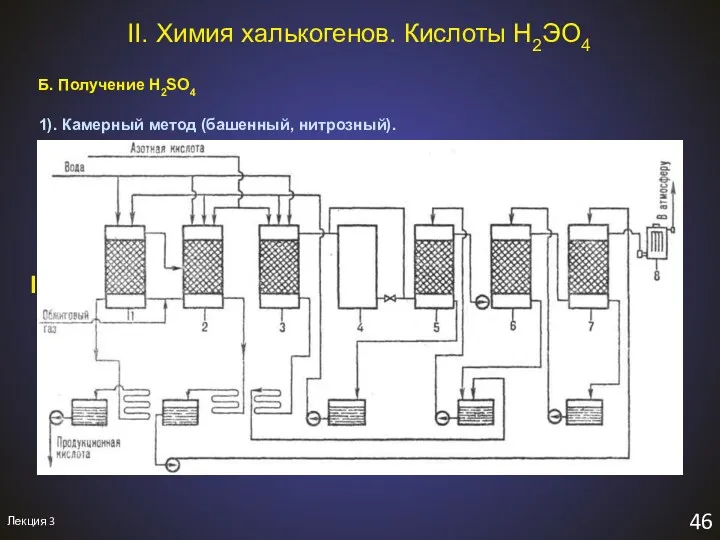
- 49. Лекция 3 46 II. Химия халькогенов. Кислоты H2ЭO4 Б. Получение H2SO4 1). Камерный метод (башенный, нитрозный).
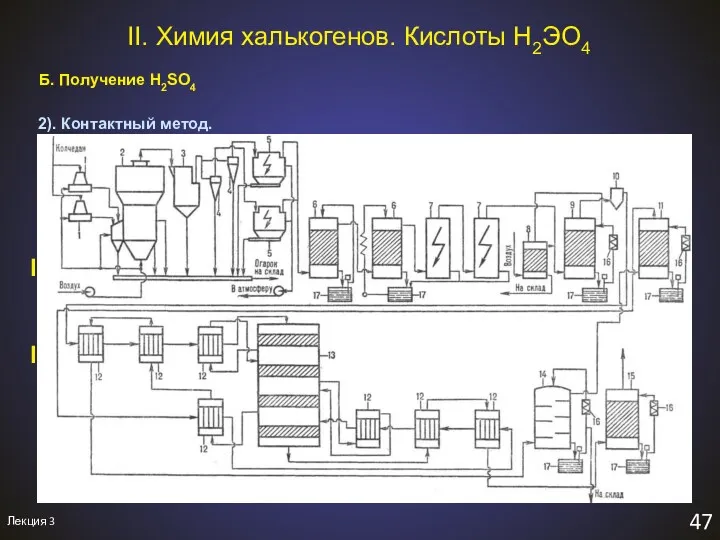
- 50. Лекция 3 47 II. Химия халькогенов. Кислоты H2ЭO4 Б. Получение H2SO4 2). Контактный метод. I. 2FeS2
- 51. Лекция 3 48 II. Химия халькогенов. Кислоты H2ЭO4 Б. Получение H2SO4 3). Купоросный метод FeSO4∙7H2O =
- 52. Лекция 3 49 II. Химия халькогенов. Кислоты H2ЭO4 Г. Химические свойства 1). Протолиз: H2ЭO4 + 2H2O
- 53. Лекция 3 50 II. Химия халькогенов. Кислоты H2ЭO4 Г. Химические свойства 3). Окислительные свойства: 2H2SO4(конц) +
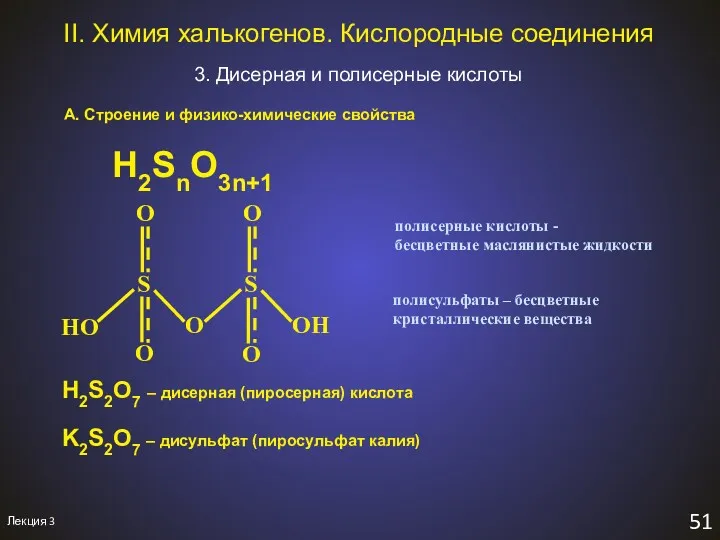
- 54. Лекция 3 51 II. Химия халькогенов. Кислородные соединения 3. Дисерная и полисерные кислоты А. Строение и
- 55. Лекция 1 52 Б. Получение II. Химия халькогенов. Кислородные соединения Дисерная кислота и дисульфаты H2SO4(конц) +
- 56. Московский государственный университет тонких химических технологий им. М.В. Ломоносова ХИМИЯ ЭЛЕМЕНТОВ 16 (VIA) группы Лектор: доц.,
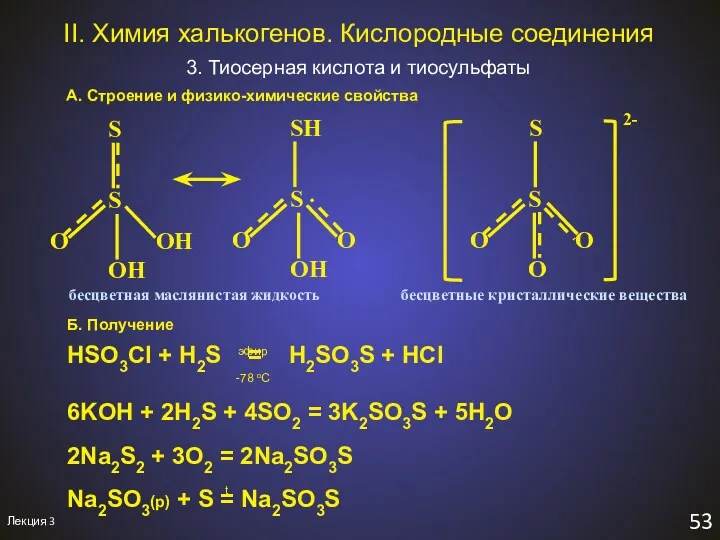
- 57. Лекция 3 53 II. Химия халькогенов. Кислородные соединения 3. Тиосерная кислота и тиосульфаты А. Строение и
- 58. Лекция 3 54 II. Химия халькогенов. Тиосульфаты В. Химические свойства 1). Термическое разложение 2). Раложение в
- 59. Лекция 3 54 II. Химия халькогенов. Тиосульфаты В. Химические свойства 4). Комплексообразующие свойства AgI (т) +
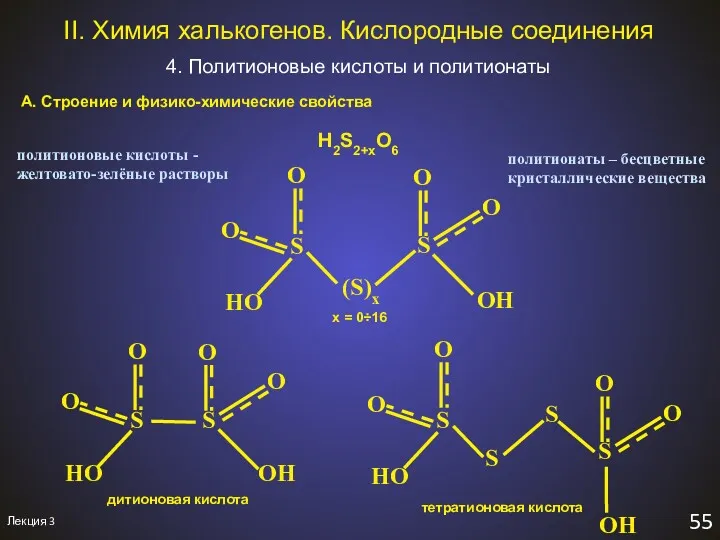
- 60. Лекция 3 55 II. Химия халькогенов. Кислородные соединения 4. Политионовые кислоты и политионаты А. Строение и
- 61. Лекция 1 56 II. Химия халькогенов. Политионаты Б. Получение H2Sx + 2SO3 = H2S2+xO6 эфир -78
- 62. Лекция 2 57 II. Химия халькогенов. Политионаты В. Химические свойства Na2S2O6 = Na2SO4 + SO2↑ 1).
- 63. Лекция 3 58 II. Химия халькогенов. Кислородные соединения. 5. Пероксокислоты А. Строение и физико-химические свойства пероксомоносерная
- 64. Лекция 3 59 II. Химия халькогенов. Пероксокислоты. Б. Получение катод: 2H3O+ + 2ē = H2 +
- 65. Лекция 3 60 II. Химия халькогенов. Пероксокислоты. В. Химические свойства 3). Взаимодействие с водой H2S2O8 +
- 66. Лекция 3 61 II. Химия халькогенов. Пероксокислоты В. Химические свойства (продолжение) 4). Окислительные свойства 5K2S2O8 +
- 68. Скачать презентацию




















































 Сравнительная характеристика галогенов
Сравнительная характеристика галогенов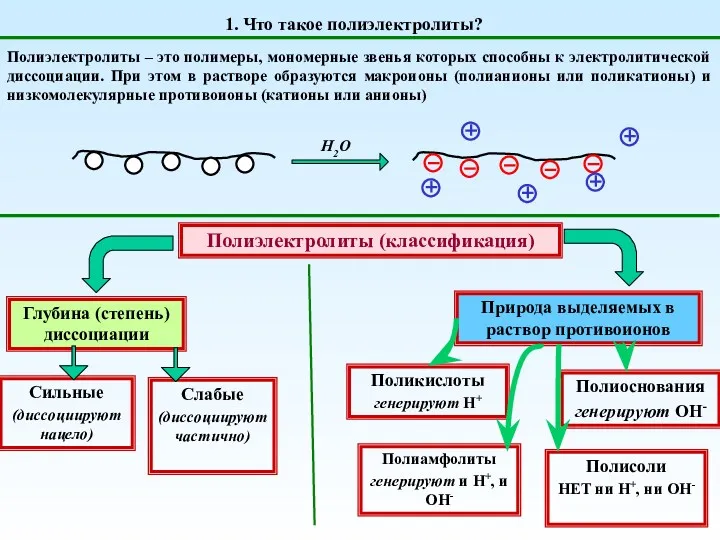 Полиэлектролиты. (Тема 3)
Полиэлектролиты. (Тема 3) Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу Материаловедение. Физические и химические структуры материалов
Материаловедение. Физические и химические структуры материалов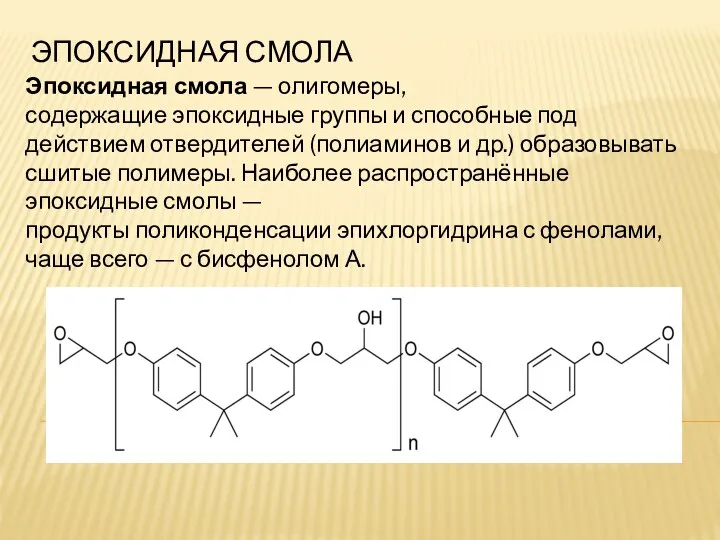 Эпоксидная смола
Эпоксидная смола Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины
Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины Щёлочноземельные металлы
Щёлочноземельные металлы Спирты. Определение. Классификация
Спирты. Определение. Классификация Кислотно-основное титрование
Кислотно-основное титрование Химический элемент и вещество
Химический элемент и вещество Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні
Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні Нуклеиновые кислоты, их структурные компоненты
Нуклеиновые кислоты, их структурные компоненты Презентации-задания к урокам химии по различным темам
Презентации-задания к урокам химии по различным темам Фосфор и его соединения
Фосфор и его соединения Алюминий на кухне - опасный враг или верный помощник?
Алюминий на кухне - опасный враг или верный помощник?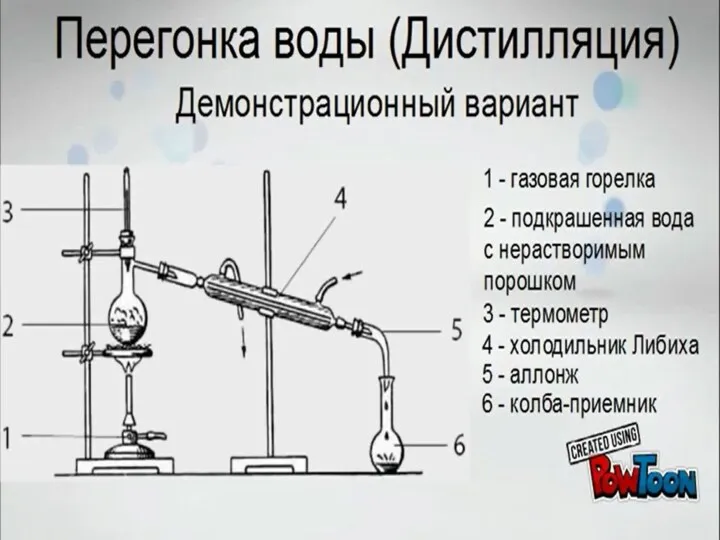 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Нано-порошки. Способы получения нано-порошков
Нано-порошки. Способы получения нано-порошков Атом - сложная частица
Атом - сложная частица Горные породы
Горные породы Алкины. Ацетилен.
Алкины. Ацетилен. Спектрофометрия
Спектрофометрия Воздух, которым мы дышим
Воздух, которым мы дышим Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Щелочные металлы
Щелочные металлы Качественные реакции
Качественные реакции Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ