Содержание
- 2. Макромолекула Макромолекула - основная структурная единица живого - включает большое количество атомов и атомных групп. Их
- 3. Структурная организация биополимеров Структурная организация биополимеров - белков и нуклеиновых кислот - имеет первоочередное значение для
- 4. Высокомолекулярные вещества, состоящие из больших молекул цепного строения, называются полимерами (от греч. "поли" - много, "мерос"
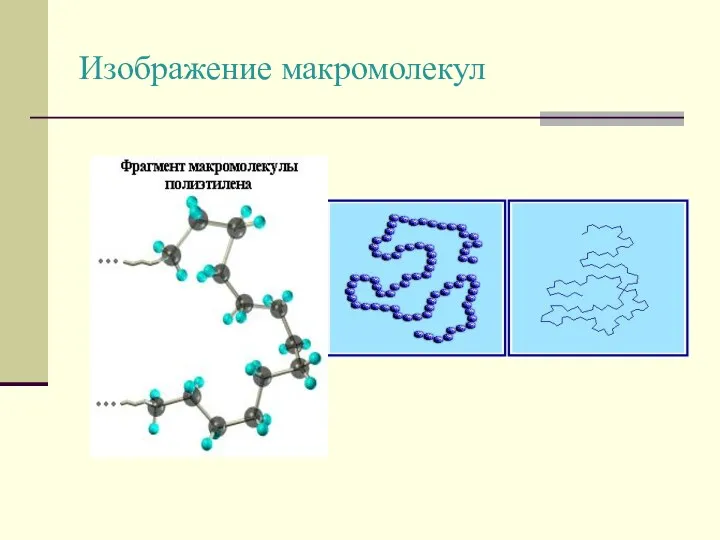
- 5. Изображение макромолекул
- 6. n X→ ( -X- )n Х – мономер, (-Х-) – структурное звено, n - степень полимеризации.
- 7. Структурное звено ...-CH2-CHCl-CH2-CHCl-CH2-CHCl-CH2-CHCl-CH2-CHCl-... Поливинилхлорид (-CH2-CHCl-)n Группа атомов, многократно повторяющаяся в цепной макромолекуле, называется ее структурным звеном.
- 8. Степень полимеризации Степень полимеризации — это число, показывающее сколько молекул мономера соединилось в макромолекулу.
- 9. Классификация полимеров По происхождению полимеры делят: на природные, биополимеры (полисахариды, белки, каучук, нуклеиновые кислоты, 2) искусственные
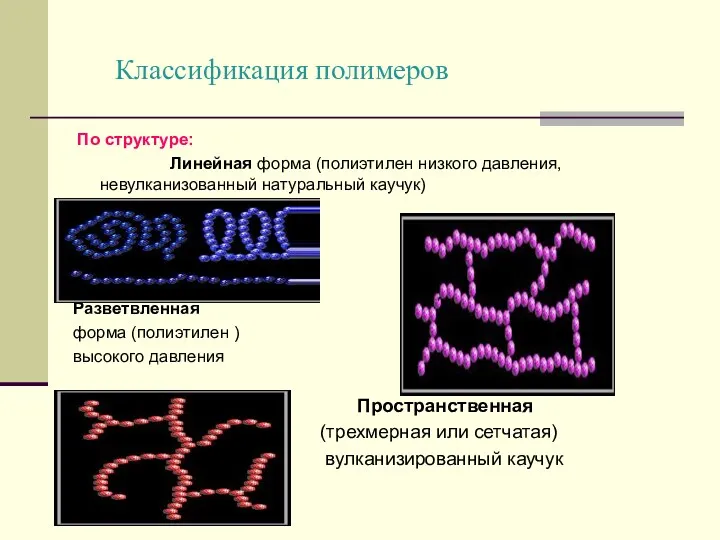
- 10. Классификация полимеров По структуре: Линейная форма (полиэтилен низкого давления, невулканизованный натуральный каучук) Разветвленная форма (полиэтилен )
- 11. Классификация полимеров По химическому составу: 1) гомополимеры (содержат одинаковые мономерные звенья); n CH2=CH2 → (–CH2–CH2–)n 2)
- 12. Классификация полимеров По пространственному строению: Стереорегулярные – высокомолекулярные соединения, макромолекулы которых состоят из определенным способом соединенных
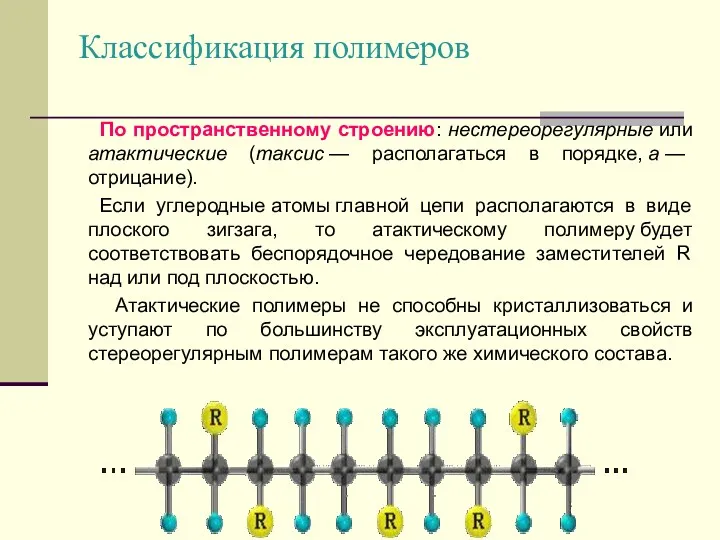
- 13. Классификация полимеров По пространственному строению: нестереорегулярные или атактические (таксис — располагаться в порядке, а — отрицание).
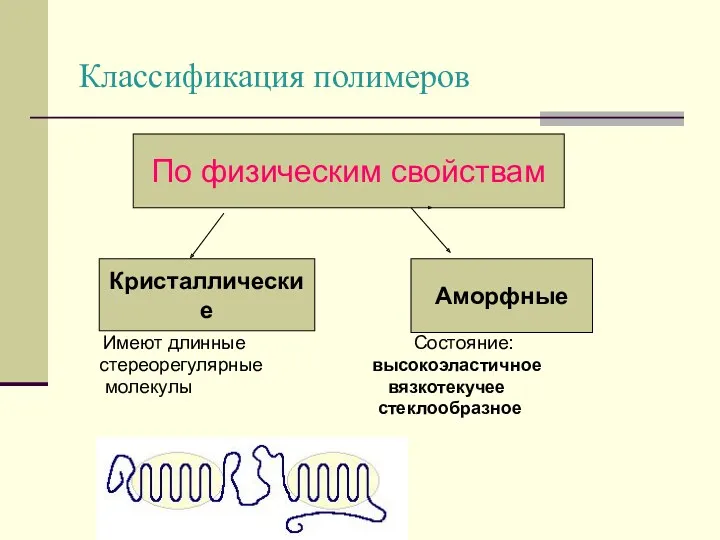
- 14. Классификация полимеров Имеют длинные Состояние: стереорегулярные высокоэластичное молекулы вязкотекучее стеклообразное По физическим свойствам Кристаллические Аморфные
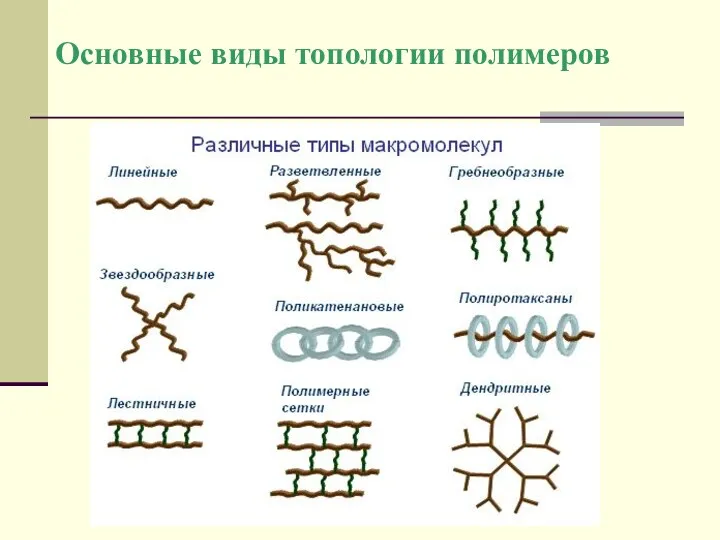
- 15. Основные виды топологии полимеров
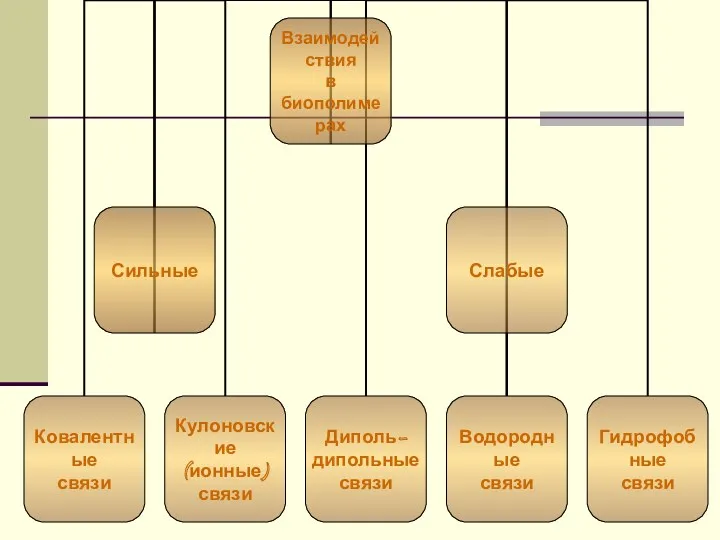
- 17. Химическая связь “Химическая связь ” - “то, что не дает самопроизвольно распасться некоторой группировке атомов, характеризуемой
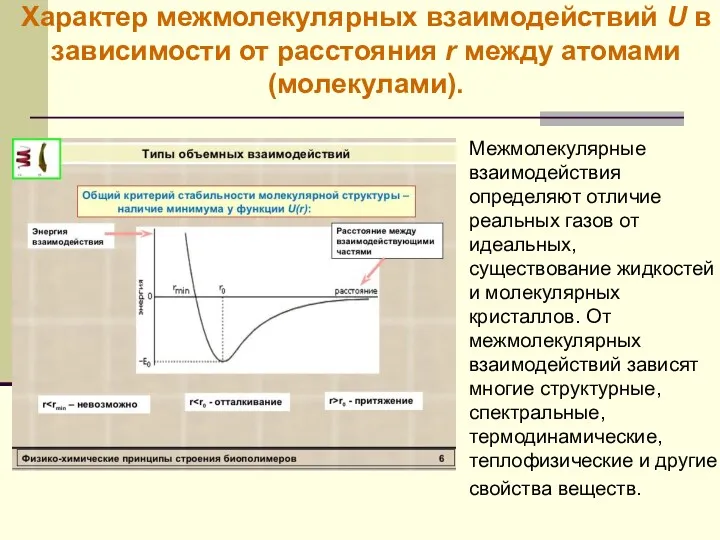
- 18. Характер межмолекулярных взаимодействий U в зависимости от расстояния r между атомами (молекулами). Межмолекулярные взаимодействия определяют отличие
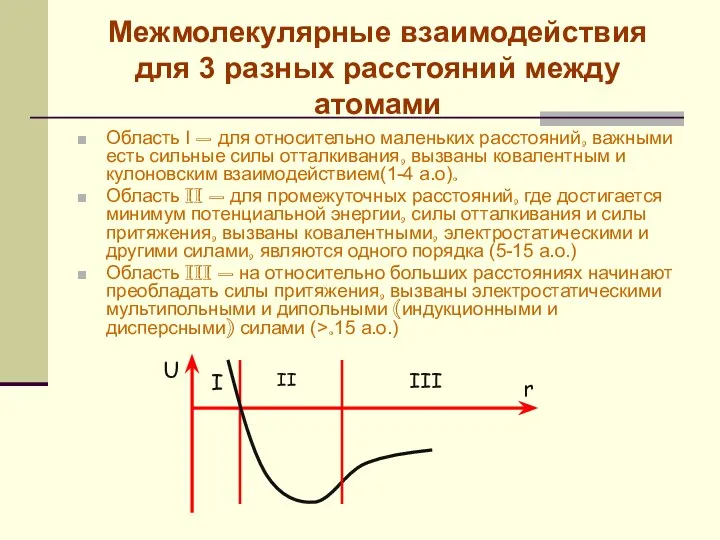
- 19. Межмолекулярные взаимодействия для 3 разных расстояний между атомами Область І – для относительно маленьких расстояний, важными
- 20. Сильные ковалентные взаимодействия Сильные ковалентные взаимодействия – это взаимодействия, вызваны внешними электронами атомов. Понятие ковалентной связи
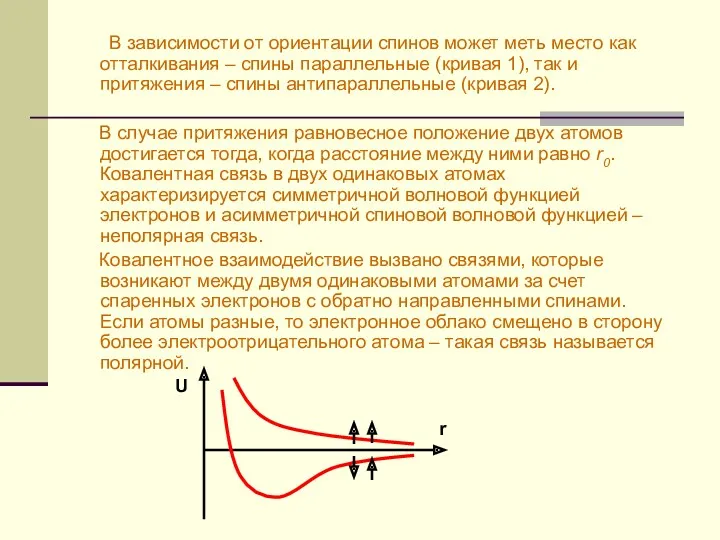
- 21. В зависимости от ориентации спинов может меть место как отталкивания – спины параллельные (кривая 1), так
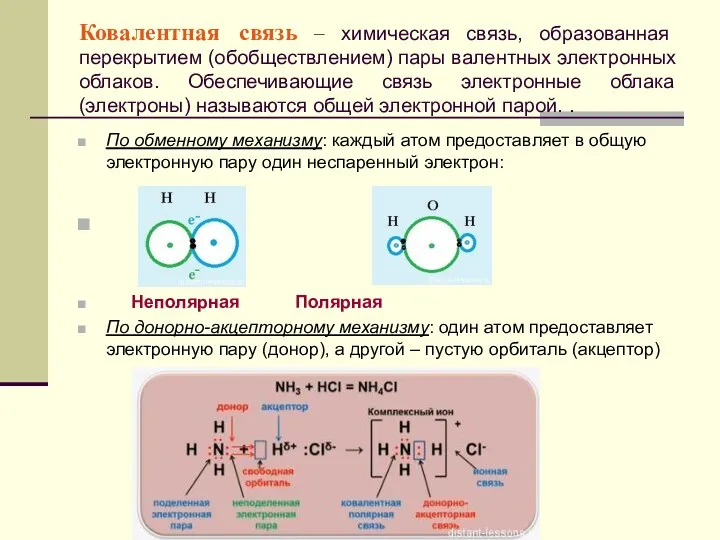
- 22. Ковалентная связь – химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака
- 23. Число общих электронных пар равно числу связей между двумя атомами, или кратности связи Простая (одинарная связь)
- 24. Параметры ковалентной связи: Длина связи – расстояние между центрами двух соседних атомов (зависит от радиуса атома
- 25. Величины сильных взаимодействий Энергия, которая необходима для разрыва С-С связи равна 349 кДж/моль, а для разрыва
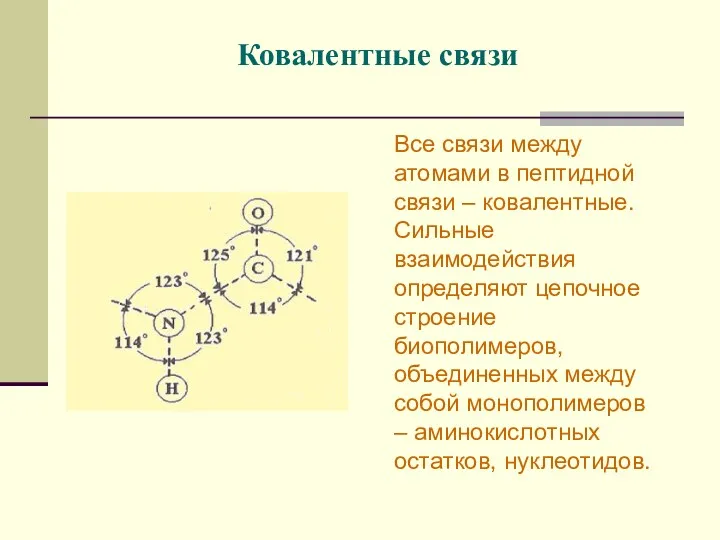
- 26. Ковалентные связи Все связи между атомами в пептидной связи – ковалентные. Сильные взаимодействия определяют цепочное строение
- 27. Ионные взаимодействия Силы взаимодействия между ионами обусловлены законом Кулона. Энергия ион-ионного взаимодействия имеет такой вид. q1,
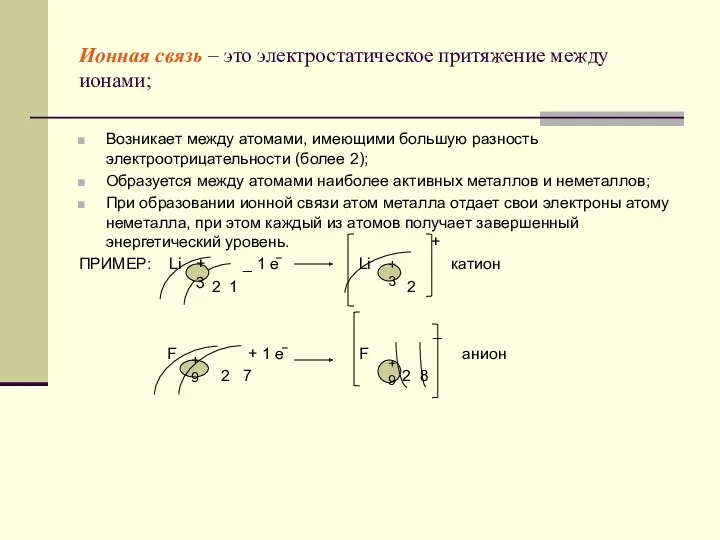
- 28. Ионная связь – это электростатическое притяжение между ионами; Возникает между атомами, имеющими большую разность электроотрицательности (более
- 29. Ионные взаимодействия Величина ионного взаимодействия имеет тот же порядок, что и при ковалентных взаимодействиях, то есть
- 30. Слабые взаимодействия Слабые взаимодействия – это взаимодействия в средине клетки и их органоидов, это взаимодействие между
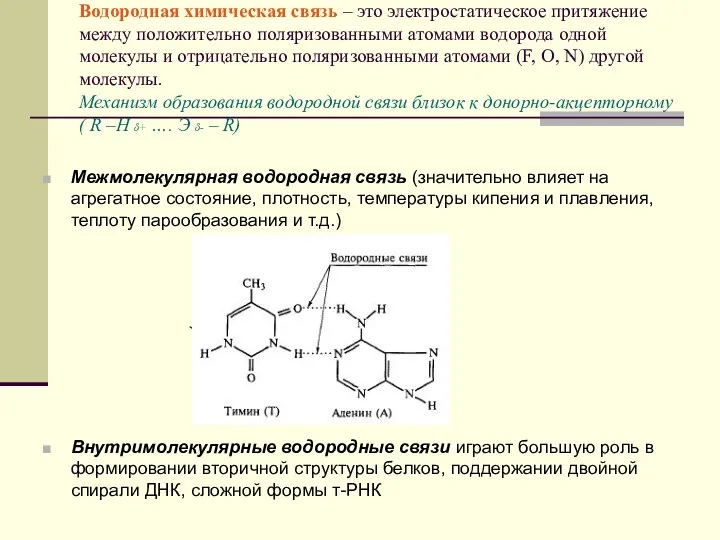
- 31. Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому
- 32. Водородная химическая связь – это электростатическое притяжение между положительно поляризованными атомами водорода одной молекулы и отрицательно
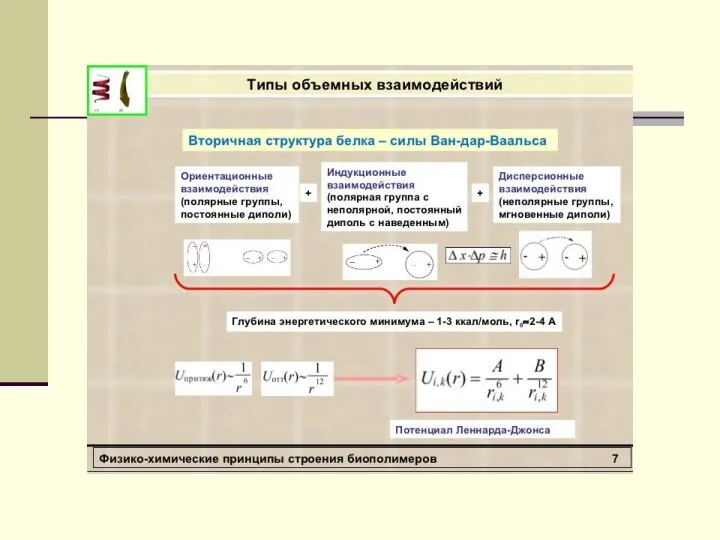
- 33. Ван-дер-Ваальсовы взаимодействия Ван-дер-ваальсовы взаимодействия и связи Ван- дер-Ваальса - взаимодействия, обусловленные так называемыми ориентационными, индукционными, дисперсионными
- 34. Связи Ван-дер-Ваальса Связи Ван-дер-Ваальса – ненаправленные. • Структуры, в которых основным видом скрепляющих связей являются Ван-дер-
- 35. Ван-дер-ваальсова (межмолекулярная) связь Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен кулоновскими силами взаимодействия
- 36. Энергии ван-дер-ваальсовых взаимодействий Энергии ван-дер-ваальсовых взаимодействий обычно несколько (4-12) кДж/моль. Ван-дер-ваальсовы взаимодействия обычно описывают в рамках
- 37. Ван-дер-ваальсовы взаимодействия
- 38. Ион-дипольные взаимодействия Потенциал ион-дипольного взаимодействия зависит от заряда иона q0 и дипольного момента p=ql полярной группы
- 39. Диполь-дипольное взаимодействие Диполь-дипольное взаимодействие – это взаимодействие между диполями молекул или полярными группами молекул. Типы диполь-дипольных
- 42. Диполь-дипольное взаимодействие Если два диполя сориентированы параллельно друг другу (при низких температурах или сильному электрическому поле),
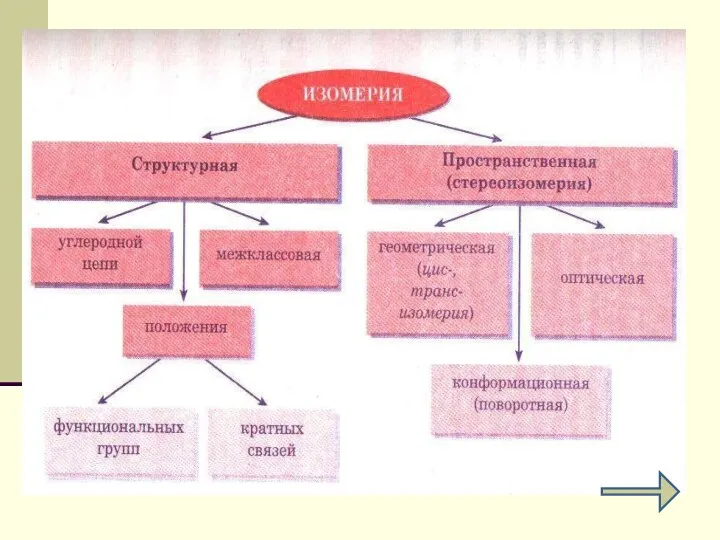
- 43. Изомеры Изомеры - вещества, имеющие один и тот же состав и одну и ту же молекулярную
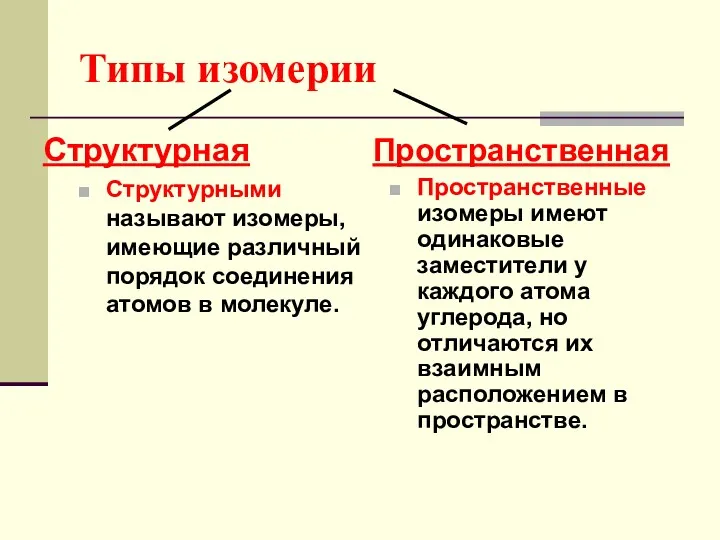
- 45. Типы изомерии Структурная Структурными называют изомеры, имеющие различный порядок соединения атомов в молекуле. Пространственная Пространственные изомеры
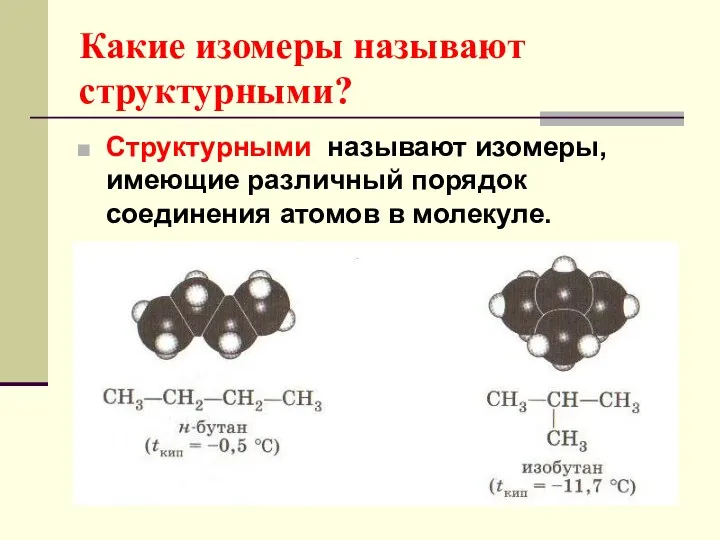
- 46. Какие изомеры называют структурными? Структурными называют изомеры, имеющие различный порядок соединения атомов в молекуле.
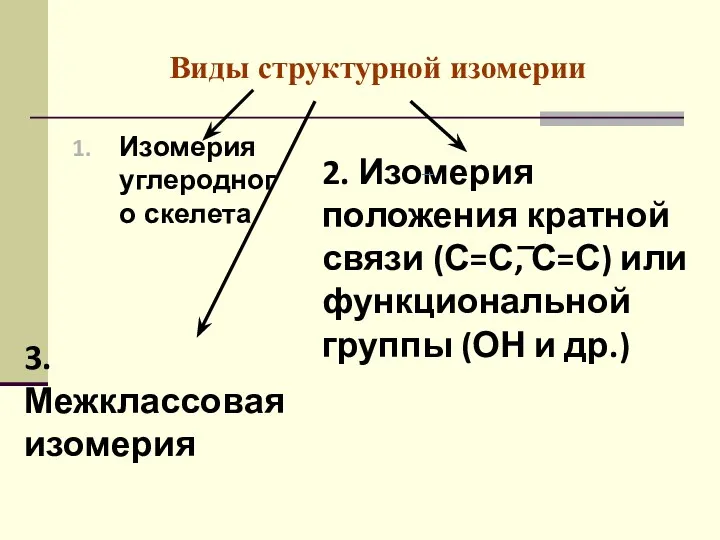
- 47. Виды структурной изомерии Изомерия углеродного скелета 2. Изомерия положения кратной связи (С=С, С=С) или функциональной группы
- 48. Виды структурной изомерии: 3. Межклассовая изомерия Изомеры относятся к разным классам органических соединений. СН3 СН2 ОН
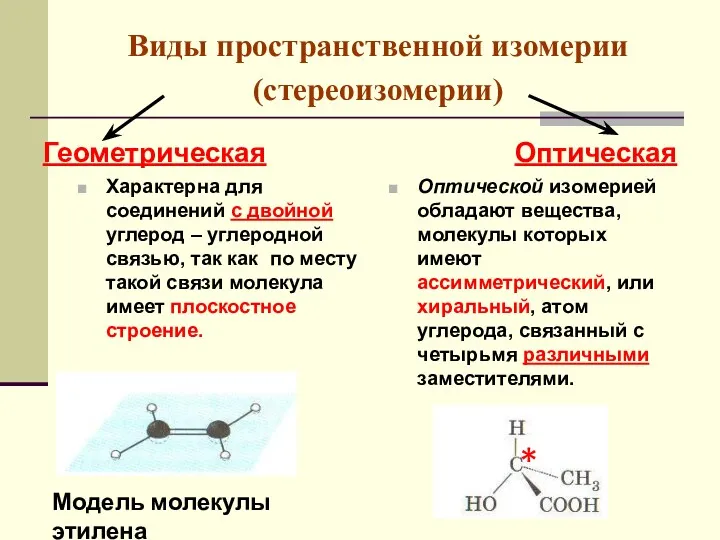
- 49. Виды пространственной изомерии (стереоизомерии) Геометрическая Характерна для соединений с двойной углерод – углеродной связью, так как
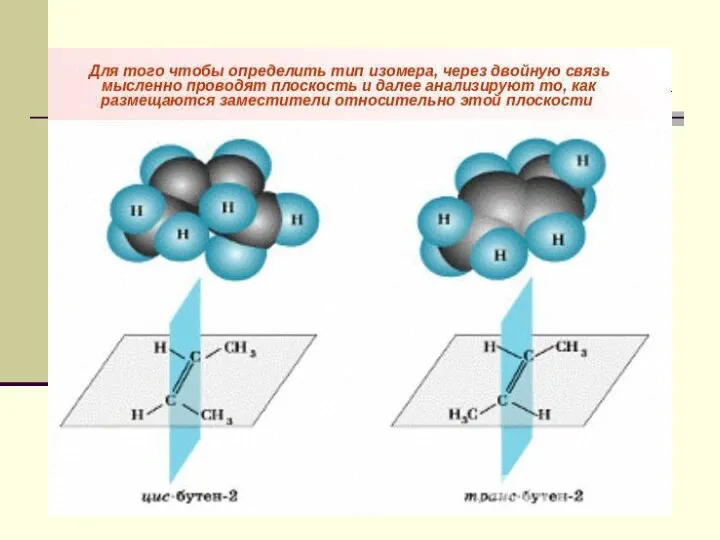
- 50. Виды пространственной изомерии Геометрическая Например, для бутена-2, если одинаковые группы атомов у атомов углерода при двойной
- 51. Стереоизомерия Стереохимия (от греч. stereos - пространственный) - это «химия в трех измерениях». Большинство молекул трехмерны
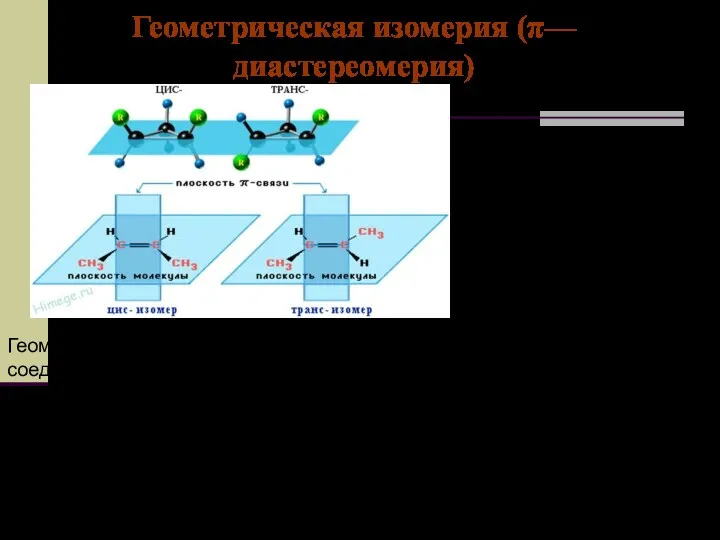
- 52. Геометрическая изомерия (π—диастереомерия) π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей
- 54. Цис-транс-изомери́я Цис-транс-изомери́я заключается в возможности расположения заместителей по одну (цис-изомер; например, рис. I) или по разные
- 55. Оптическая изомерия Оптическая изомерия характерна для многих природных соединений. Особенно большое значение она имеет для углеводов
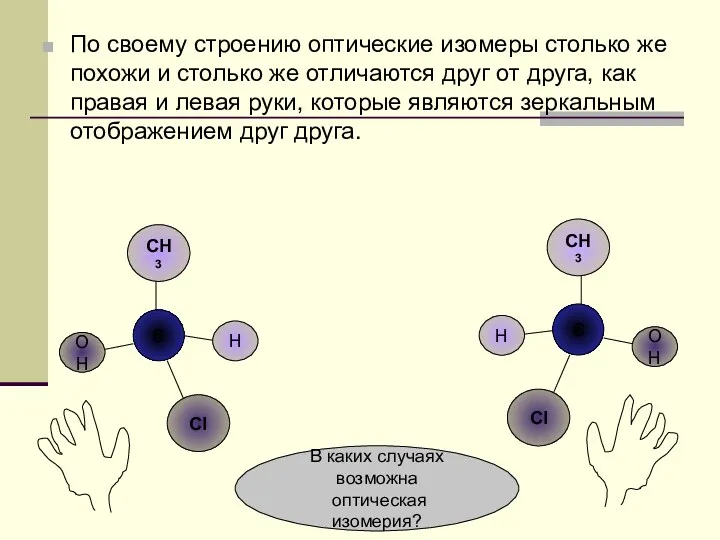
- 56. По своему строению оптические изомеры столько же похожи и столько же отличаются друг от друга, как
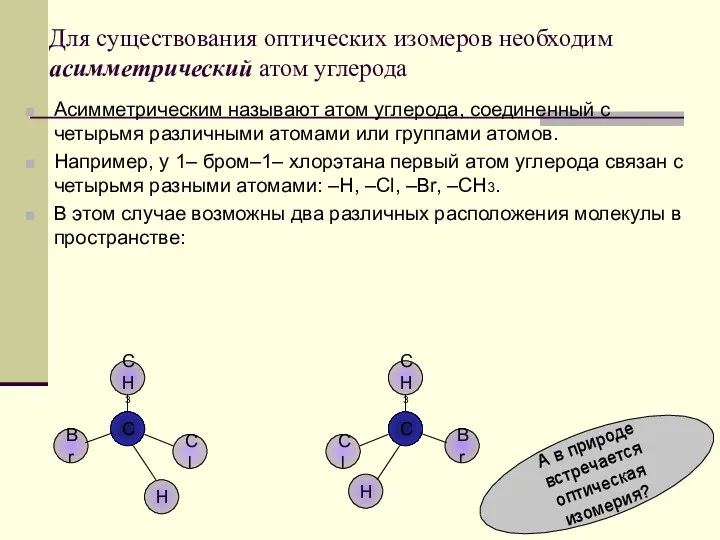
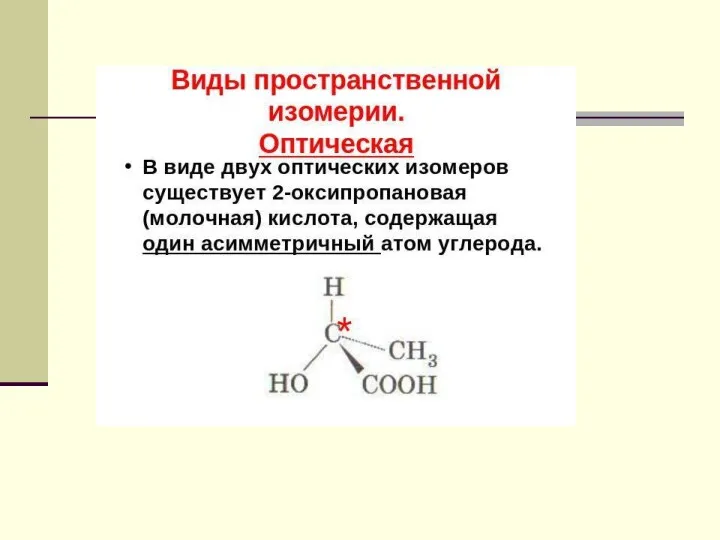
- 57. Для существования оптических изомеров необходим асимметрический атом углерода Асимметрическим называют атом углерода, соединенный с четырьмя различными
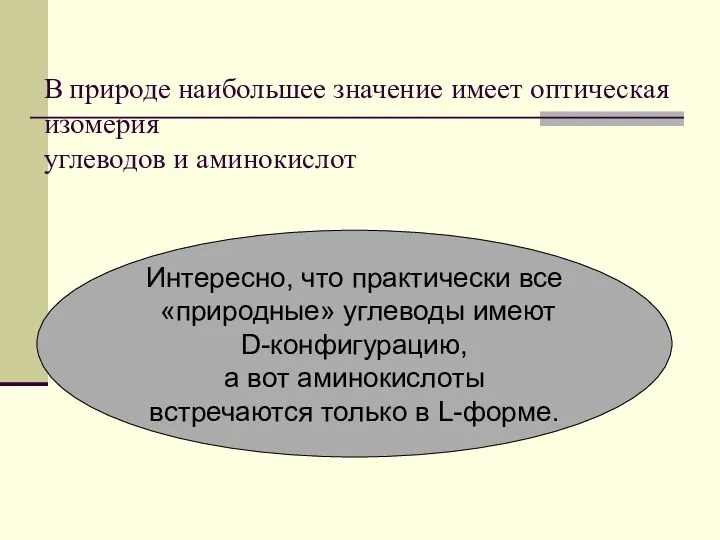
- 58. В природе наибольшее значение имеет оптическая изомерия углеводов и аминокислот Интересно, что практически все «природные» углеводы
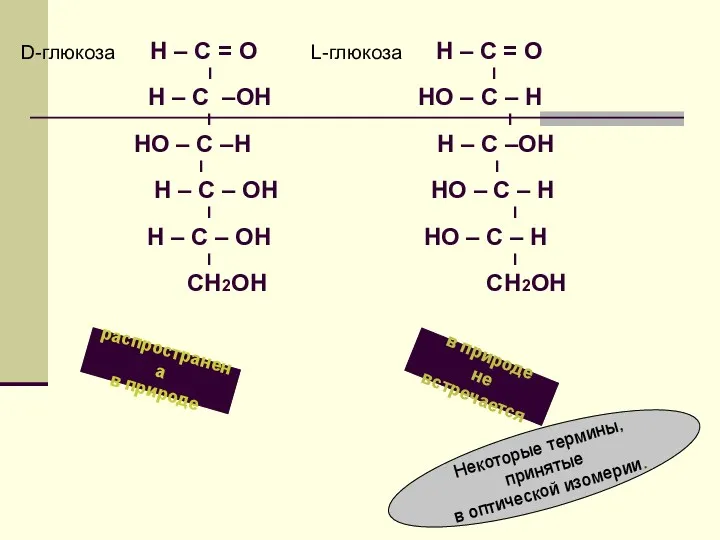
- 59. D-глюкоза H – C = О L-глюкоза Н – С = O I I H –
- 60. Некоторые термины Оптическая изомерия – иначе зеркальная изомерия или энантиомерия. Оптические изомеры – иначе называются зеркальными
- 61. Хиральность Атом углерода в sp3-гибридизации имеет тетраэдрическую конфигурацию. Если из 4 заместителей, хотя бы 2 одинаковые,
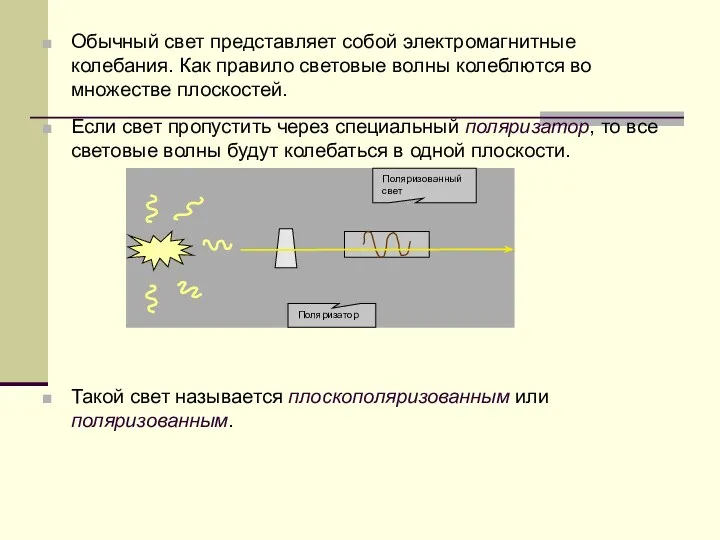
- 62. Обычный свет представляет собой электромагнитные колебания. Как правило световые волны колеблются во множестве плоскостей. Если свет
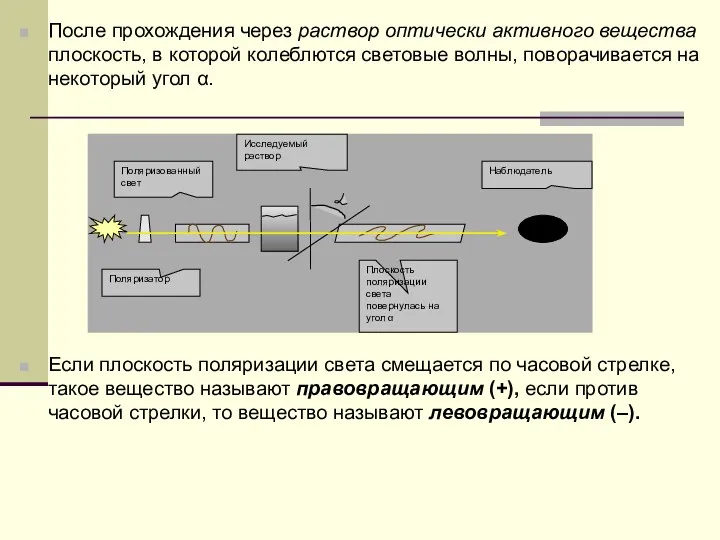
- 63. В 1815г Жан Батист Био открыл явление оптической активности – способности жидкости изменять (отклонять на некоторый
- 64. После прохождения через раствор оптически активного вещества плоскость, в которой колеблются световые волны, поворачивается на некоторый
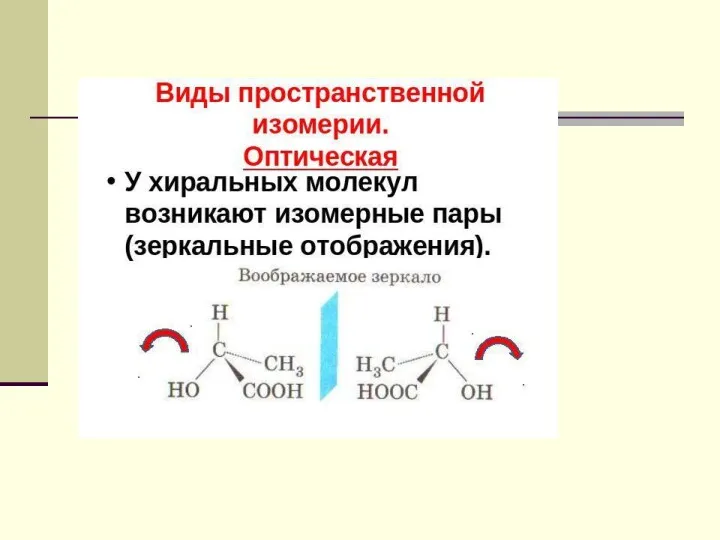
- 65. Энантиомеры Энантиомеры или оптические антиподы - это два хиральных стереоизомера, которые являются зеркальным изображением друг друга.
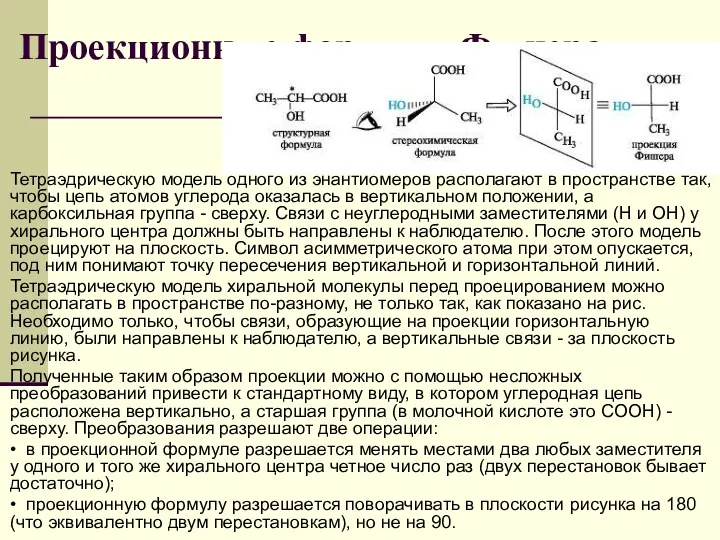
- 66. Проекционные формулы Фишера Стереоизомеры с одним центром хиральности. Молекулы, имеющие центры хиральности на плоскости принято изображать
- 67. Проекционные формулы Фишера. Тетраэдрическую модель одного из энантиомеров располагают в пространстве так, чтобы цепь атомов углерода
- 68. D.L-Система обозначения конфигурации. В начале ХХ в. была предложена система классификации энантиомеров для относительно простых (с
- 69. Отнесение к d- или l-ряду других родственных по структуре оптически активных соединений производится путем сравнения конфигурации
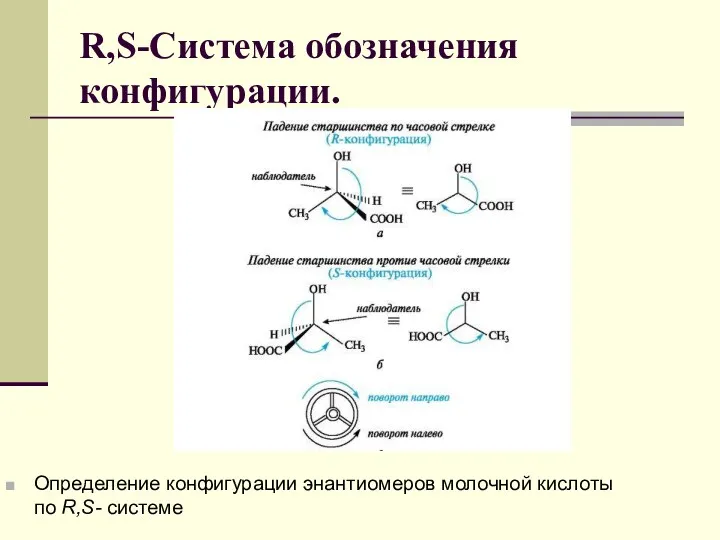
- 70. R,S-Система обозначения конфигурации. Определение конфигурации энантиомеров молочной кислоты по R,S- системе
- 75. Скачать презентацию









































 Цветные металлы и сплавы
Цветные металлы и сплавы Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Гидролиз неорганических солей
Гидролиз неорганических солей Химия в быту
Химия в быту Предмет органической химии
Предмет органической химии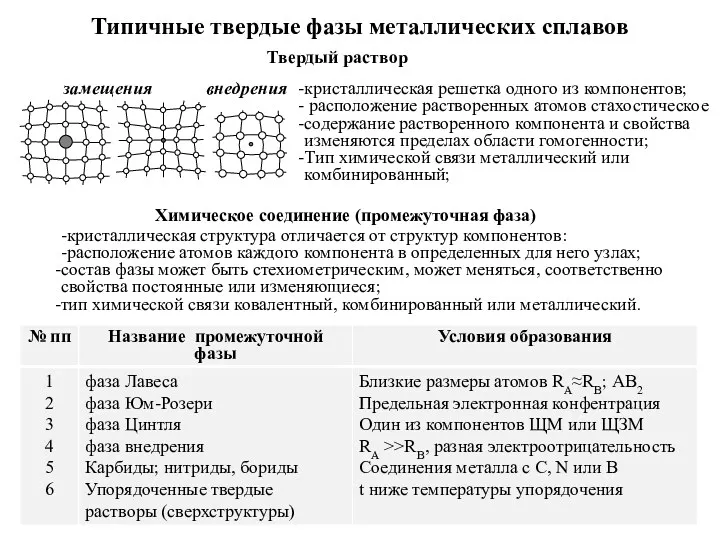 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Топливный элемент
Топливный элемент kremniy
kremniy Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома Простые вещества металлы
Простые вещества металлы Кислые породы умеренно-щелочного ряда
Кислые породы умеренно-щелочного ряда Why use plastics
Why use plastics Получение наночастиц в сверхкритическом флюиде
Получение наночастиц в сверхкритическом флюиде 20230330_metodicheskaya_razrabotka_ovr_v_organicheskoy_himii
20230330_metodicheskaya_razrabotka_ovr_v_organicheskoy_himii Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Молярный объём газов
Молярный объём газов 20230316_otkrytyy_urok_v_8_kl_geneticheskaya_svyaz.docx
20230316_otkrytyy_urok_v_8_kl_geneticheskaya_svyaz.docx 20230306_oni_byli_pervymi
20230306_oni_byli_pervymi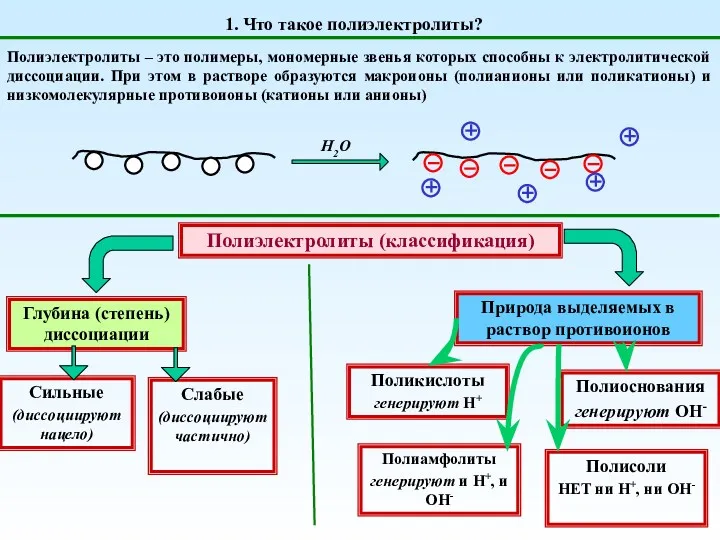 Полиэлектролиты. (Тема 3)
Полиэлектролиты. (Тема 3) Классификация химических реакций
Классификация химических реакций Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Удивительные свойства воды
Удивительные свойства воды Гель-хроматография. Бумажная хроматография
Гель-хроматография. Бумажная хроматография Гомологический ряд алканов. Изомерия и номенклатура
Гомологический ряд алканов. Изомерия и номенклатура Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива
Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива Азот. Строение атома и молекулы
Азот. Строение атома и молекулы Удобрения. 9 класс
Удобрения. 9 класс Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция