Содержание
- 2. Кремний Silicium Si «Силекс»(лат.) – кремень «Кремнос» (греч.) - утёс, скала
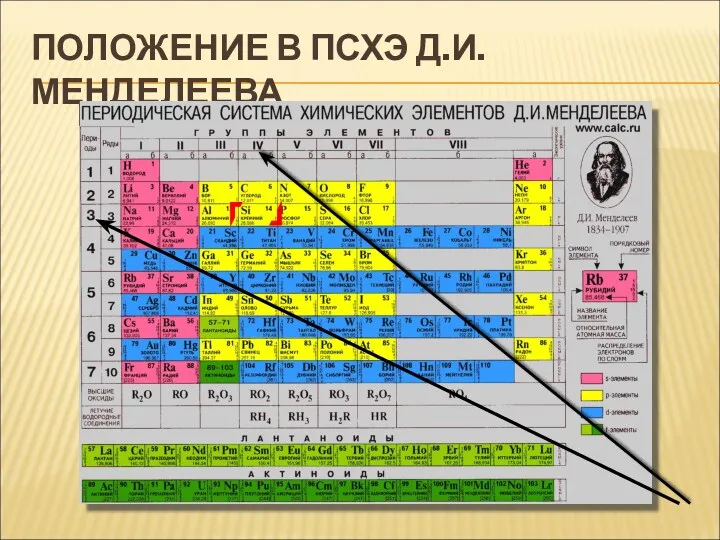
- 3. ПОЛОЖЕНИЕ В ПСХЭ Д.И.МЕНДЕЛЕЕВА
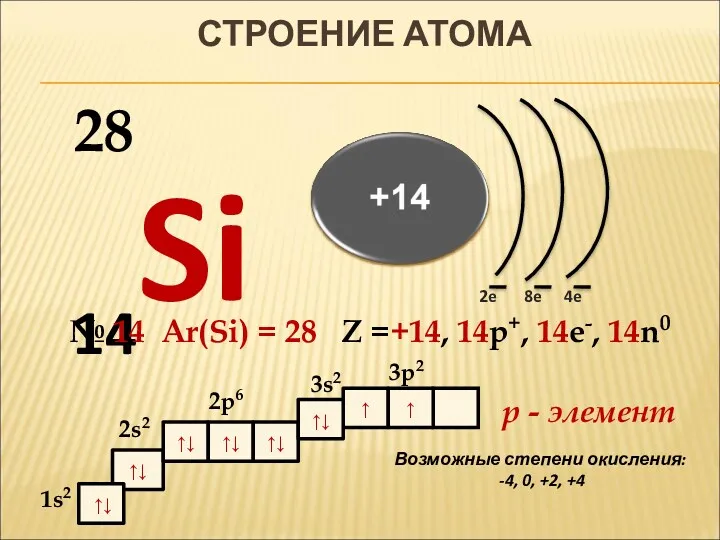
- 4. ↑ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 1s2 СТРОЕНИЕ АТОМА 14Si 2e 4e 8e № 14 Ar(Si)
- 5. АЛЛОТРОПИЯ КРЕМНИЯ Кристаллический кремний Аморфный кремний темно-серого цвета, обладающий стальным блеском, твердый и хрупкий, с плотностью
- 6. НАХОЖДЕНИЕ В ПРИРОДЕ SiO2 кремнезём (песок) Al2O3∙ 2SiO2∙2H2O каолинит (глина) По распространенности занимает второе место после
- 7. ПРИМЕНЕНИЕ КРЕМНИЯ Кремнистые стали Силиконовый каучук Фотоэлементы Силиконовый герметик
- 8. Силикон – это материал, который очень герметичный и выдерживает при работе большой диапазон температур от -1200С
- 9. 1. В промышленности кремний получают восстановлением диоксида кремния коксом в электрических печах: SiO2+2C=Si+2CO ПОЛУЧЕНИЕ КРЕМНИЯ SiO2
- 10. ХИМИЧЕСКИЕ СВОЙСТВА 1. С галогенами Непосредственно взаимодействует только с фтором, при этом проявляет восстановительные свойства: Si
- 11. 4. С металлами (проявляет окислительные свойства) : 2Ca + Si = Ca2Si 5. С кислотами взаимодействует
- 12. Кремний участвует в различных обменных процессах как катализатор. Есть основания считать, что самостарение в немалой степени
- 13. Кремний - обычный компонент растений, стимулирующий их рост, упрочняет ткани растений и снижает потерю воды. Рекордсменами
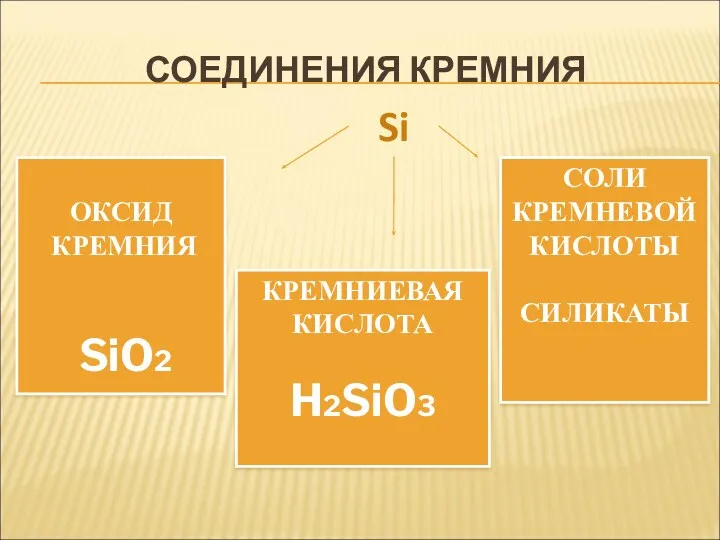
- 14. СОЕДИНЕНИЯ КРЕМНИЯ ОКСИД КРЕМНИЯ SiO2 КРЕМНИЕВАЯ КИСЛОТА H2SiO3 СОЛИ КРЕМНЕВОЙ КИСЛОТЫ СИЛИКАТЫ Si
- 15. ОКСИД КРЕМНИЯ В ПРИРОДЕ Горный хрусталь Халцедон Кварц Аметист Агат Сердолик Песок, ракушки
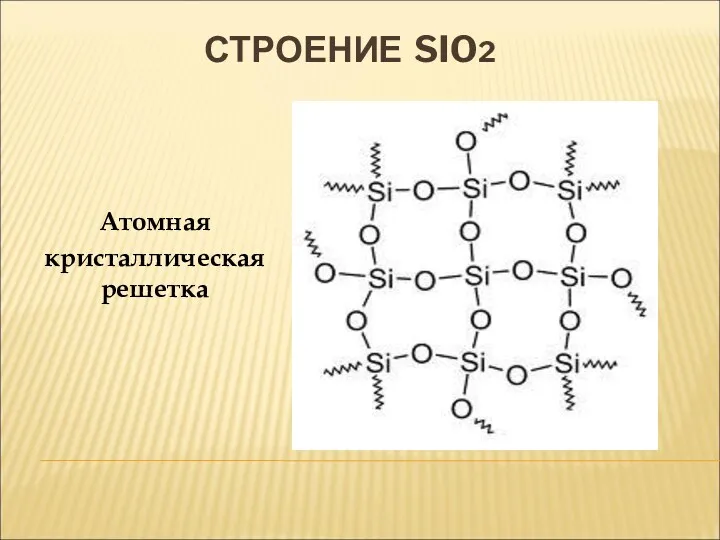
- 16. СТРОЕНИЕ SIO2 Атомная кристаллическая решетка
- 17. СОЕДИНЕНИЯ КРЕМНИЯ ОКСИД КРЕМНИЯ - SIO2 Твердое кристаллическое вещество Атомная кристаллическая решётка Очень твёрдый Нерастворим в
- 18. SIO2 ПРИДАЕТ ПРОЧНОСТЬ СТЕБЛЯМ РАСТЕНИЙ И ЗАЩИТНЫМ ПОКРОВАМ ЖИВОТНЫХ
- 19. ПРИМЕНЕНИЕ SIO2 Силикатный кирпич стекло при получении клеящих и вяжущих материалов
- 20. ОКСИД КРЕМНИЯ(IV), ИЛИ КРЕМНЕЗЁМ ЯВЛЯЕТСЯ КИСЛОТНЫМ ОКСИДОМ. Не растворяется в кислотах (кроме HF) плавиковая кислота SiO2
- 21. КАКОВЫ КОМПОНЕНТЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ИЗГОТОВЛЕНИЯ ОБЫЧНОГО СТЕКЛА? Они спекаются при высокой температуре, и получается однородная масса
- 22. КРЕМНИЕВАЯ КИСЛОТА H2SIO3 Na2SiO3 + 2HCl =2NaCl + H2SiO3 ↓ силикат натрия кремневая кислота Получение: Кремниевая
- 23. Двухосновная Кислородсодержащая Слабая Нестабильная Нелетучая Нерастворимая При нагревании разлагается: H2SiO3 → SiO2 + H2O КРЕМНИЕВАЯ КИСЛОТА
- 24. СОЛИ КРЕМНЕВОЙ КИСЛОТЫ Растворимые силикаты натрия и калия называют жидким стеклом
- 25. Аморфный кремний - это малая энергетика. Солнечные батареи из аморфного кремния не боятся ни снега, ни
- 26. Кремниевые солнечные батареи для освещения улиц и домов – это наше настоящее и будущее. Они эффективны
- 27. Кремний и его соединения необходимы для хорошего состояния кожи, они придают ей эластичность и прочность. Кремний
- 29. Скачать презентацию






















 Мембранное материаловедение. Топливные элементы
Мембранное материаловедение. Топливные элементы Камни и Козерог
Камни и Козерог Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution
Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution Классификация химических реакций
Классификация химических реакций Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Классы неорганических соединений
Классы неорганических соединений Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Альдегиды и кетоны
Альдегиды и кетоны Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Фенолфармальдегидные смолы
Фенолфармальдегидные смолы Дисперсные системы
Дисперсные системы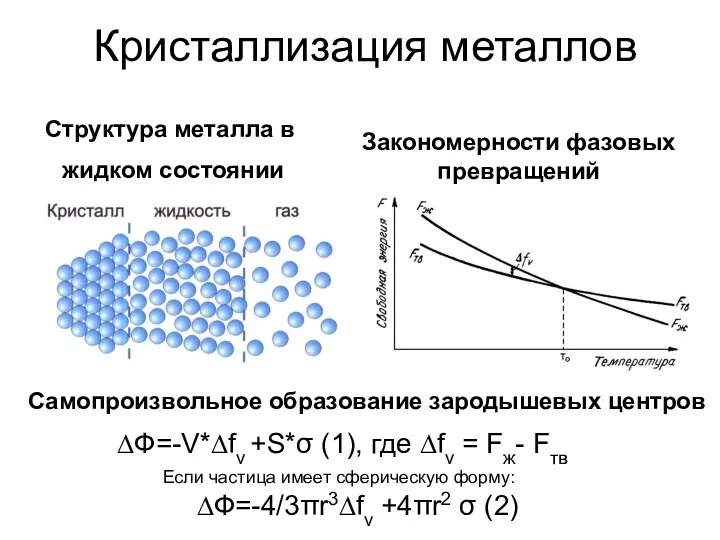 Закономерности фазовых превращений
Закономерности фазовых превращений Органическая химия
Органическая химия Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Основания
Основания Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Хімічні та фізичні явища
Хімічні та фізичні явища Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Методы прямого секвенирования белков (пептидов)
Методы прямого секвенирования белков (пептидов) Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Материаловедение. Химия функциональных материалов
Материаловедение. Химия функциональных материалов Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2) Электроповерхностные явления. Строение двойного электрического слоя
Электроповерхностные явления. Строение двойного электрического слоя Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства