Содержание
- 2. Аммиак NH3 – это самое важное из водородных соединений азота. В чистом виде аммиак впервые был
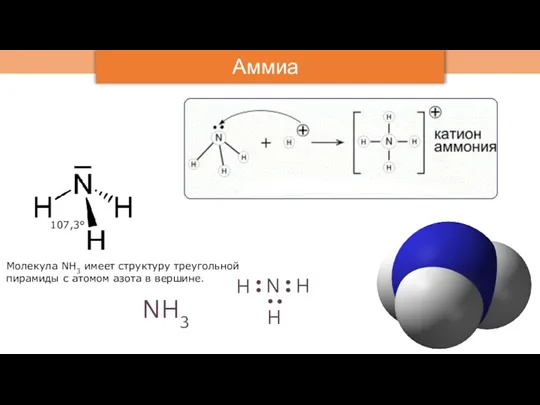
- 3. Аммиак NH3 N H H H Молекула NH3 имеет структуру треугольной пирамиды с атомом азота в
- 4. Физические свойства
- 5. Бесцветный газ с резким запахом, порог восприятия запаха 37 мг. Плотность его по отношению к воздуху
- 7. Действие на организм Аммиак сильно раздражает слизистые оболочки уже при 0,5%-ном содержании его в воздухе. Острое
- 8. Распознать аммиак можно: По характерному запаху Используя влажную лакмусовую бумажку, которая в присутствии аммиака приобретёт синюю
- 9. Применение аммиака Использование в холодильных установках Производство азотной кислоты Производство минеральных удобрений Использование для паяния Для
- 10. Не пахнут магазинские цветы? Обработайте их аммиаком. Изменить можно и цвет бутонов. Так, от паров реагента
- 11. Аммиак – это нашатырный спирт. Гидроксид аммония содержится и в моче, а так же, в продуктах
- 12. Применение в быту
- 13. При выводе пятен хорошие результаты дают во многих случаях следующие составы (по объёму): а) 4 части
- 16. Скачать презентацию












 Строение электронных оболочек атомов
Строение электронных оболочек атомов Растворы ВМС
Растворы ВМС Промышленные типы месторождений железа
Промышленные типы месторождений железа Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях Химия нефти и газа
Химия нефти и газа Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів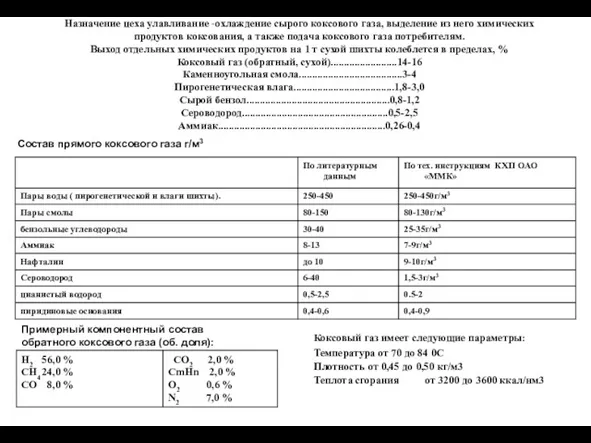 Охлаждение сырого коксового газа, выделение из него химических продуктов коксования
Охлаждение сырого коксового газа, выделение из него химических продуктов коксования Переходные элементы
Переходные элементы Низкомолекулярные компоненты сыворотки крови
Низкомолекулярные компоненты сыворотки крови Гидролиз неорганических веществ - солей. (11 класс)
Гидролиз неорганических веществ - солей. (11 класс) Крекинг нефти
Крекинг нефти Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Аминокислоты. Номенклатура
Аминокислоты. Номенклатура Детонаційна стійкість бензину
Детонаційна стійкість бензину Алкадиены
Алкадиены Класифікація неорганічних сполук, їхній склад і номенклатура
Класифікація неорганічних сполук, їхній склад і номенклатура Азот
Азот Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Техника безопасности на уроках химии. Решение экспериментальных задач по теме Неметаллы. Практическая работа №2
Техника безопасности на уроках химии. Решение экспериментальных задач по теме Неметаллы. Практическая работа №2 Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Количество вещества. Молярная масса и молярный объем
Количество вещества. Молярная масса и молярный объем Урок + презентация Азот. 9 класс.
Урок + презентация Азот. 9 класс. Цепные химические реакции
Цепные химические реакции Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз
Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз Йод в нашей жизни
Йод в нашей жизни Степень окисления. Подготовка к контрольной работе
Степень окисления. Подготовка к контрольной работе Основные электрохимические процессы
Основные электрохимические процессы