Содержание
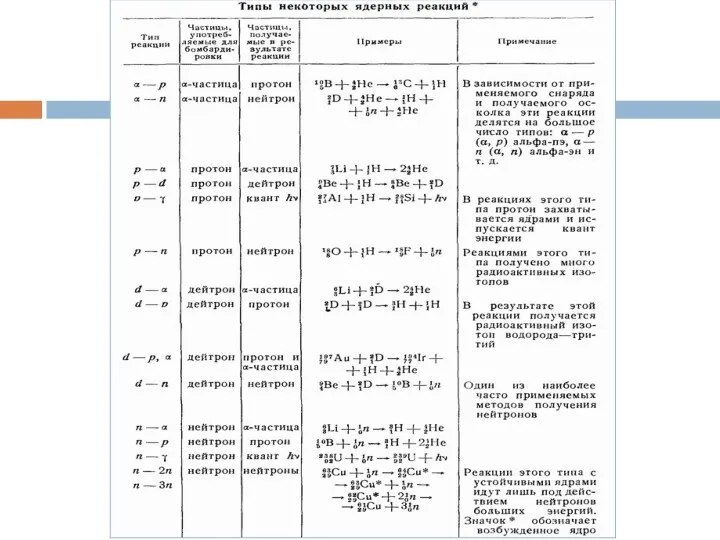
- 2. Упражнения – стр. 46 Я́дерная реа́кция — процесс образования новых ядер или частиц при столкновениях ядер
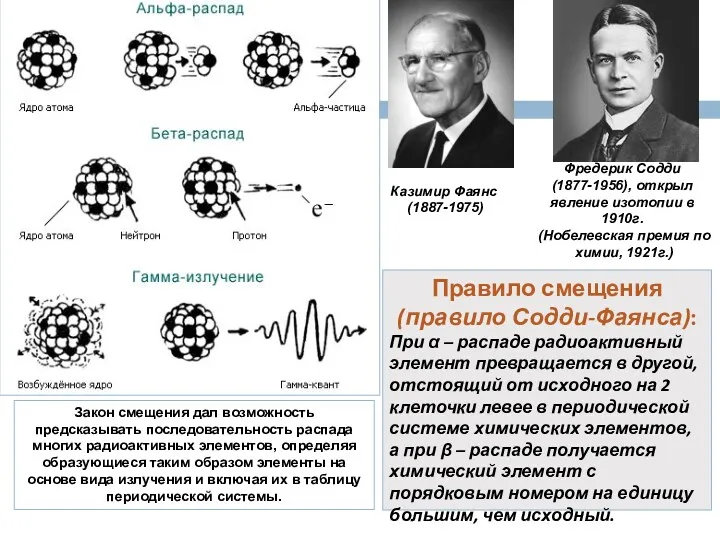
- 3. Правило смещения (правило Содди-Фаянса): При α – распаде радиоактивный элемент превращается в другой, отстоящий от исходного
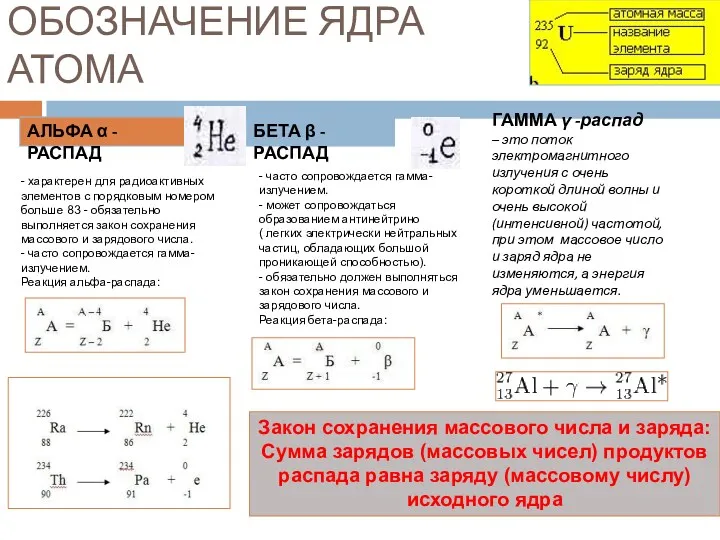
- 4. ОБОЗНАЧЕНИЕ ЯДРА АТОМА АЛЬФА α - РАСПАД - характерен для радиоактивных элементов с порядковым номером больше
- 5. Написание уравнений ядерных реакций
- 7. Ответьте на вопросы Чем можно объяснить различие в свойствах элементов? Причина – различие атомов (различное число
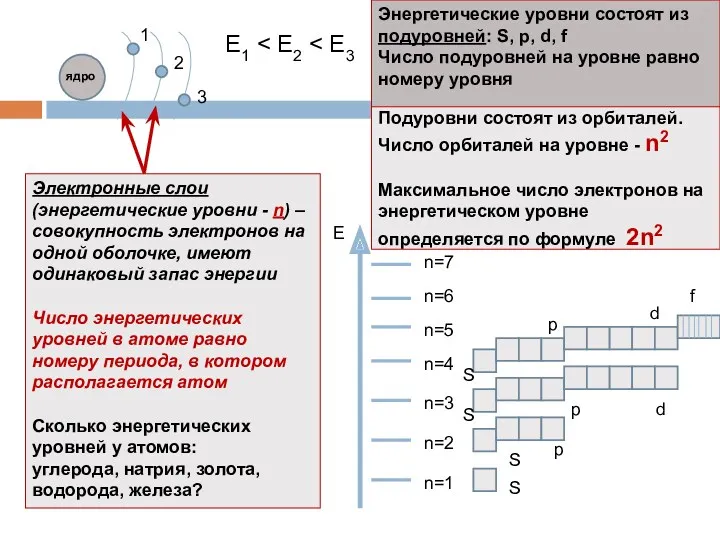
- 8. Электронная оболочка Совокупность всех электронов в атоме, окружающих ядро Каждый электрон имеет свою траекторию движения и
- 9. Подуровни состоят из орбиталей. Число орбиталей на уровне - n2 Максимальное число электронов на энергетическом уровне
- 10. Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной устойчивостью и стабильностью Энергетические уровни,
- 11. Запомните! Электроны, расположенные на последней электронной оболочке, называются внешними. Число внешних электронов для химических элементов главных
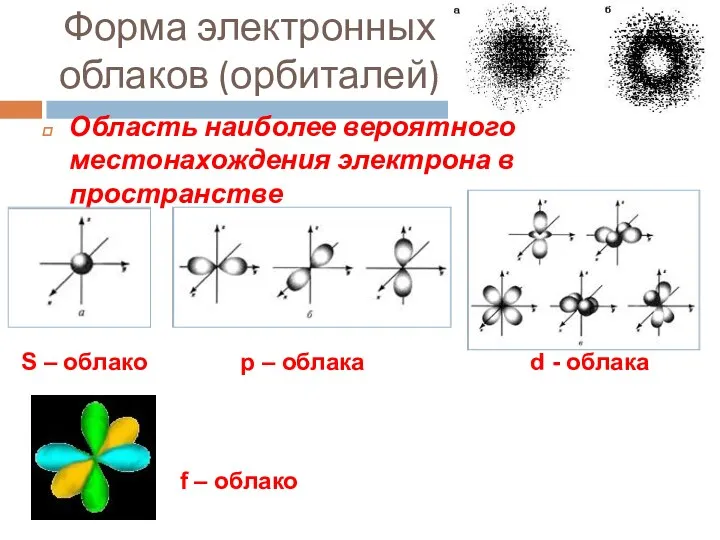
- 12. Форма электронных облаков (орбиталей) Область наиболее вероятного местонахождения электрона в пространстве S – облако р –
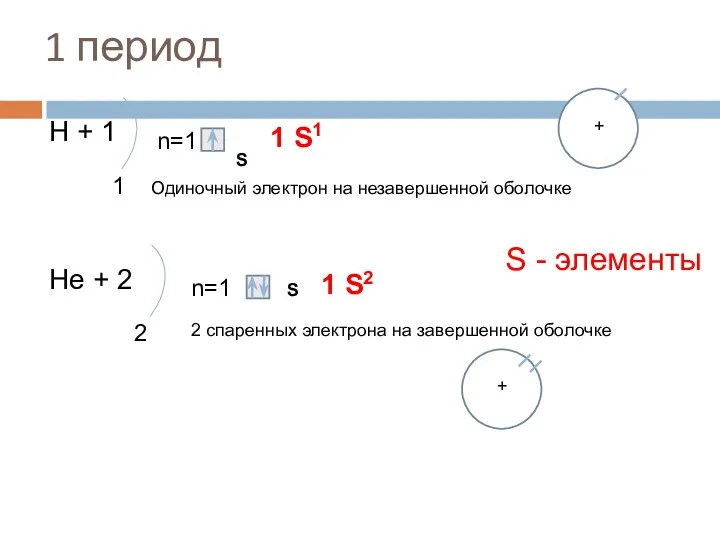
- 13. 1 период Н + 1 1 n=1 S 1 S1 Нe + 2 2 n=1 S
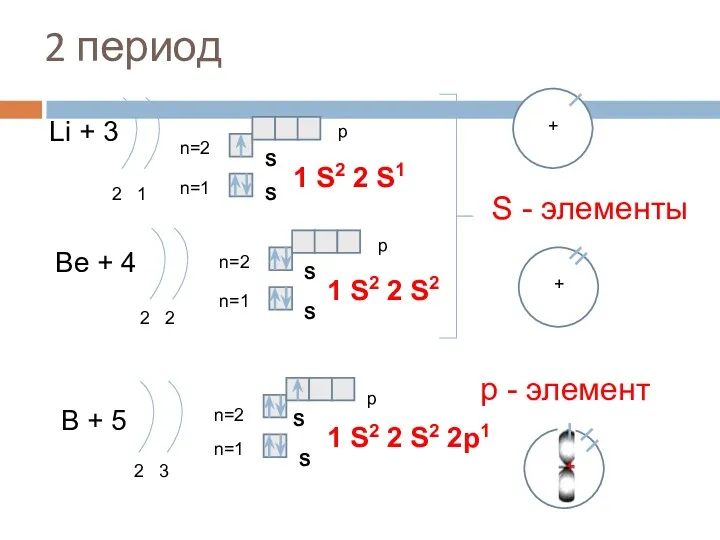
- 14. 2 период Li + 3 2 1 n=1 n=2 1 S2 2 S1 Be + 4
- 15. 2 период С + 6 2 4 n=1 n=2 N + 7 2 5 n=1 n=2
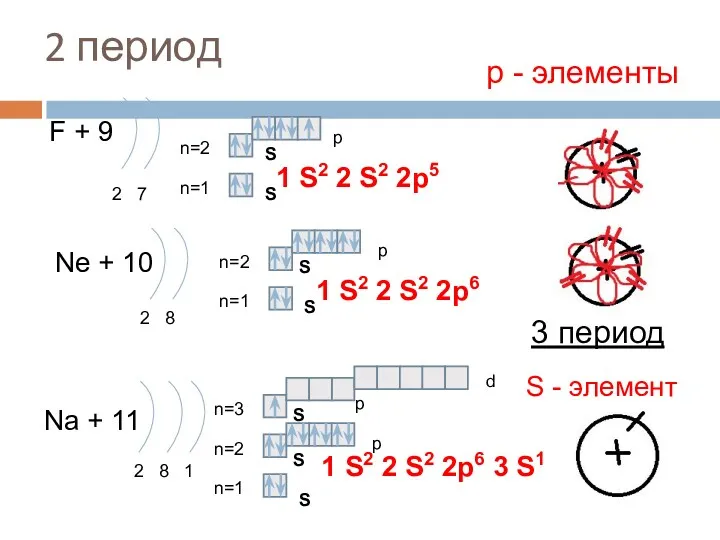
- 16. 2 период F + 9 2 7 n=1 n=2 Ne + 10 2 8 n=1 n=2
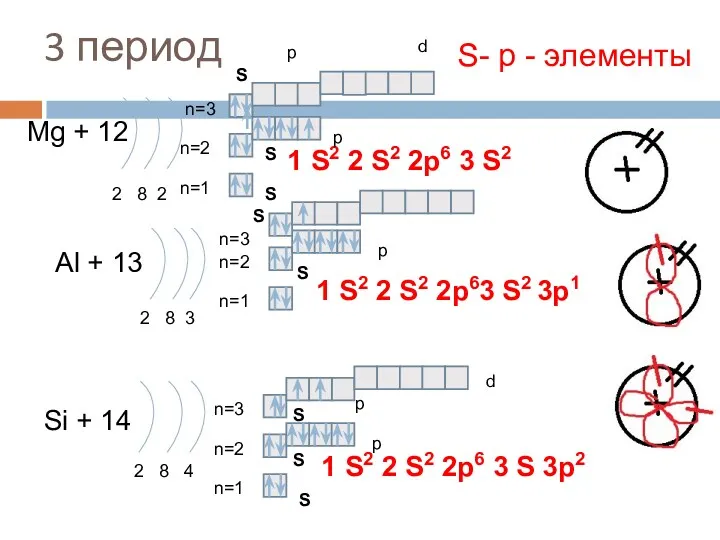
- 17. 3 период Mg + 12 2 8 2 n=1 n=2 Al + 13 2 8 3
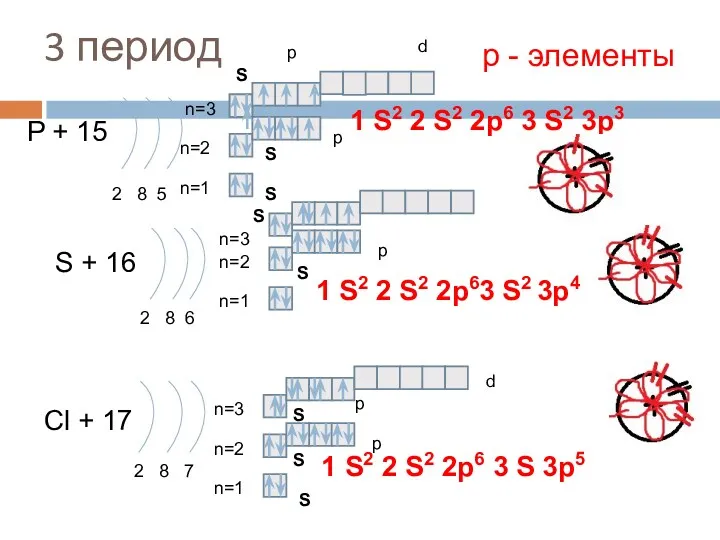
- 18. 3 период P + 15 2 8 5 n=1 n=2 S + 16 2 8 6
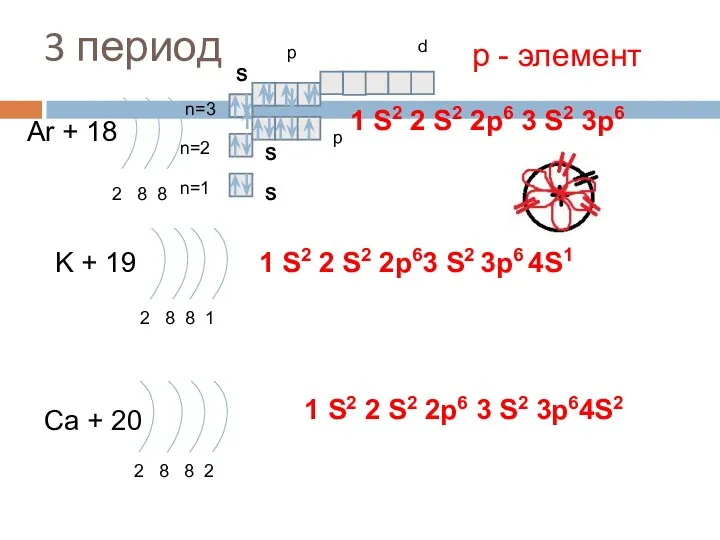
- 19. 3 период Ar + 18 2 8 8 n=1 n=2 K + 19 2 8 8
- 21. Скачать презентацию







 Оксид углерода II. Угарный газ
Оксид углерода II. Угарный газ Железо. Физические свойства
Железо. Физические свойства Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Учение о растворах
Учение о растворах Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Алюминий. Группы элементов
Алюминий. Группы элементов Энергетика химических процессов. Химическая термодинамика
Энергетика химических процессов. Химическая термодинамика Вода з точки зору хімії
Вода з точки зору хімії Аммиак. Состав вещества
Аммиак. Состав вещества Методы очистки натрия от примесей
Методы очистки натрия от примесей Поликонденсация. Фенолформальдегидные смолы
Поликонденсация. Фенолформальдегидные смолы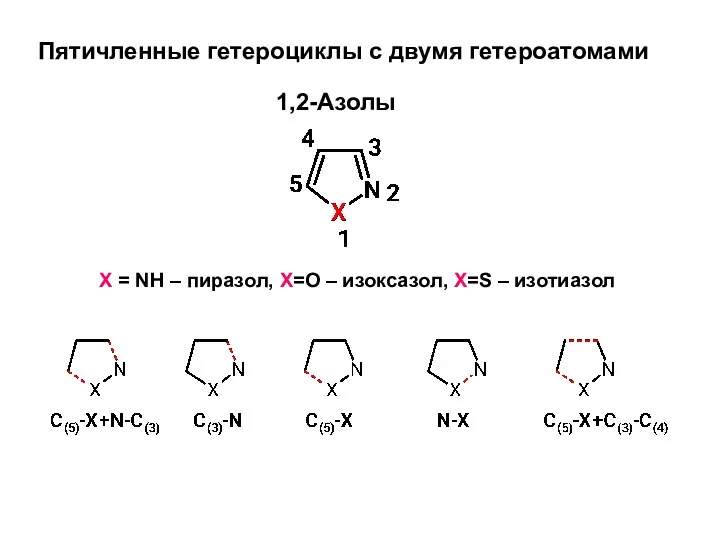 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Алюминий и его соединения
Алюминий и его соединения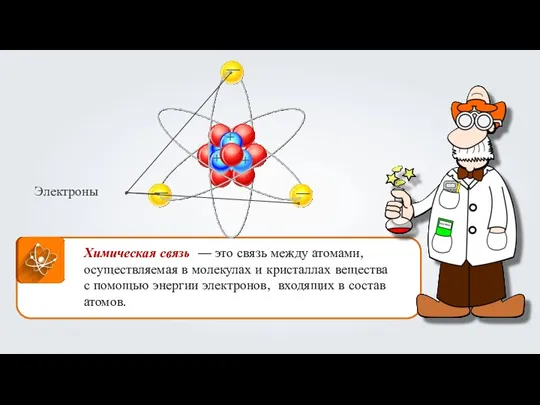 Химическая связь
Химическая связь Органическая химия. ДО. Глицерин как представитель многоатомных спиртов
Органическая химия. ДО. Глицерин как представитель многоатомных спиртов Аммиак. Строение, свойства, получение, применение
Аммиак. Строение, свойства, получение, применение Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Кафедра биохимии УГМУ в прошлом и настоящем. Локализация
Кафедра биохимии УГМУ в прошлом и настоящем. Локализация Молекулалық орбиталдың негіздері ТФП 315
Молекулалық орбиталдың негіздері ТФП 315 Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Волшебные кристалы
Волшебные кристалы Металлы. Общая характеристика
Металлы. Общая характеристика Кислоты: названия, получение, свойства, применение
Кислоты: названия, получение, свойства, применение Электрохимия. Часть 1
Электрохимия. Часть 1