Содержание
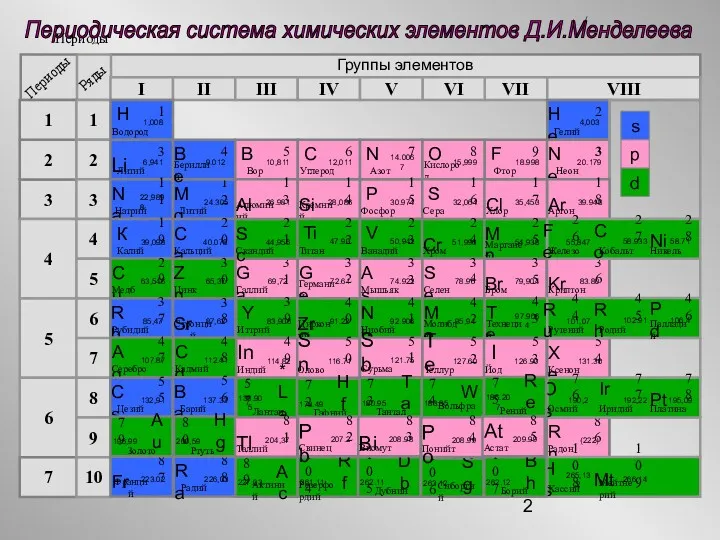
- 2. Периоды Периодическая система химических элементов Д.И.Менделеева Группы элементов I II III IV VII VI V VIII
- 3. Периодическая система химических элементов Д.И.Менделеева Группы элементов I II III IV VII VI V VIII 3
- 4. Алюминий 2. Электронное строение 5. Свойства атома 3. Строение простого вещества 4. Физические свойства 6. Химические
- 5. Алюминий 1. Из истории открытия главная Далее Впервые Al был получен датским физиком Эрстедом Х. в
- 6. Алюминий 1. Из истории открытия Главная Далее В период открытия алюминия - металл был дороже золота.
- 7. Алюминий главная Вставьте пропущенные слова Алюминий - элемент III группы, главной подгруппы. Заряд ядра атома алюминия
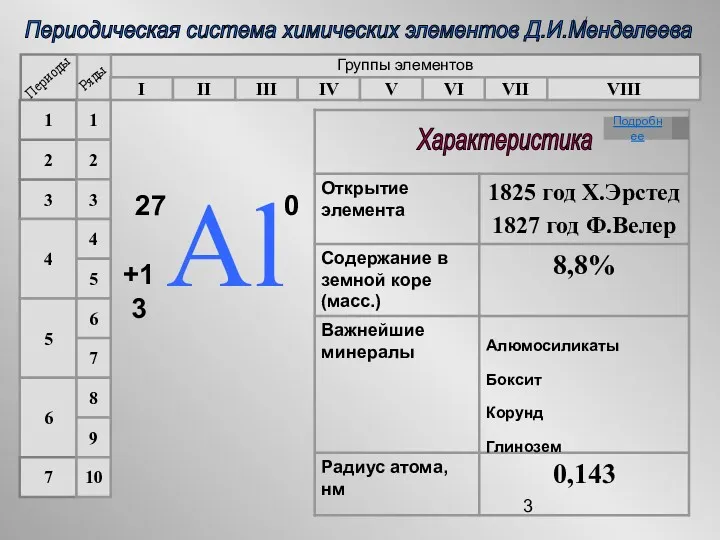
- 8. Алюминий 2. Электронное строение 27 Аl +13 0 2e 8e 3e 1s2 2s2 2p6 3s2 3p1
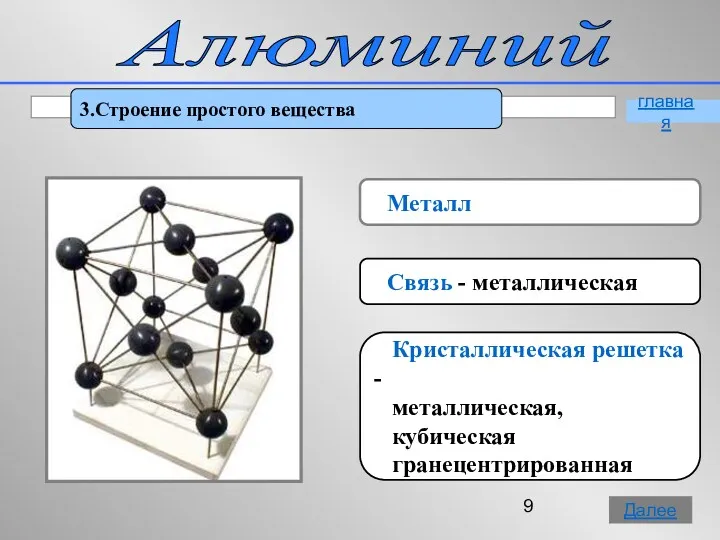
- 9. Алюминий 3.Строение простого вещества Металл Связь - металлическая Кристаллическая решетка - металлическая, кубическая гранецентрированная главная Далее
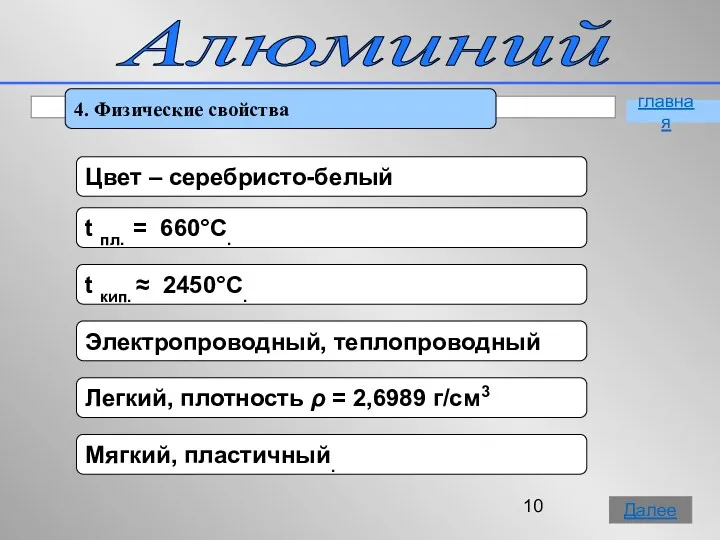
- 10. Алюминий 4. Физические свойства главная Далее
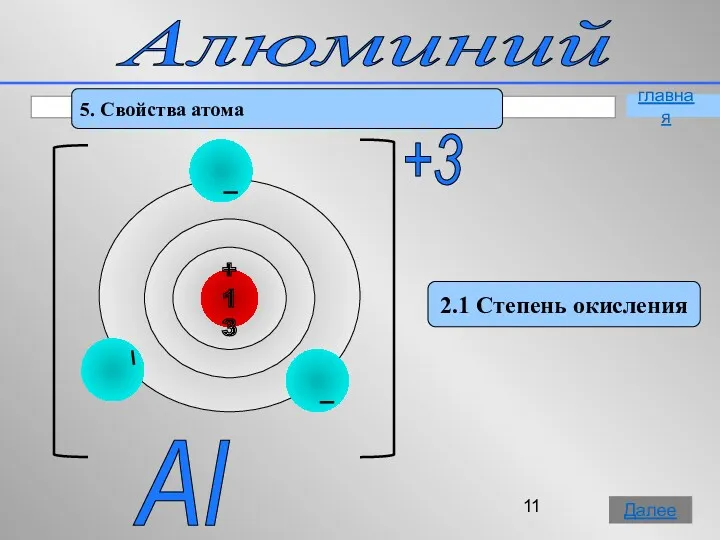
- 11. Алюминий 5. Свойства атома 2.1 Степень окисления Al +3 главная Далее
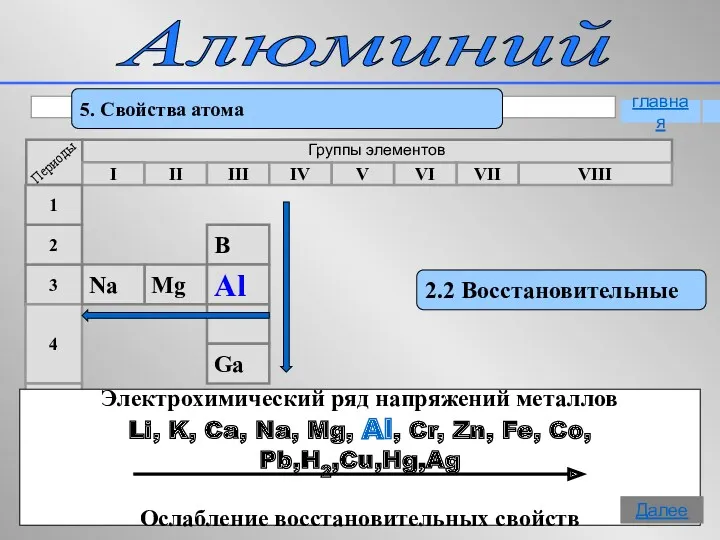
- 12. Алюминий 5. Свойства атома 2.2 Восстановительные Группы элементов I II III IV VII VI V VIII
- 13. Алюминий 6. Химические свойства 4Аl + 3O2 = 2Al2O3 t 2Al + 3S = Al2S3 C
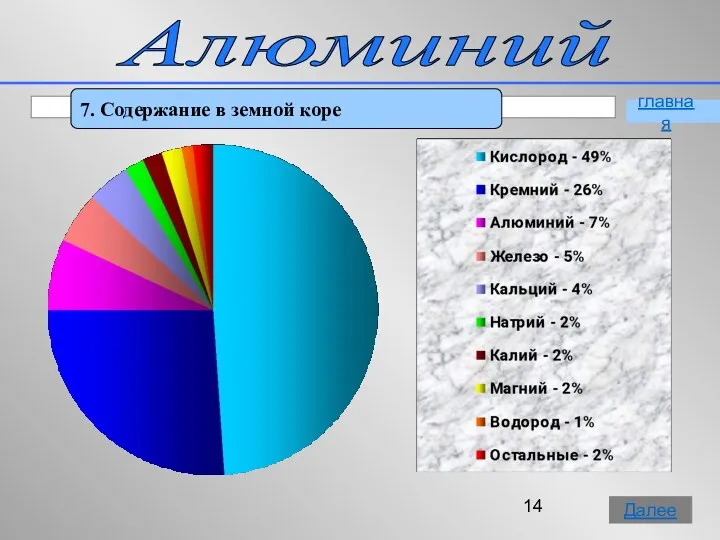
- 14. Алюминий 7. Содержание в земной коре главная Далее
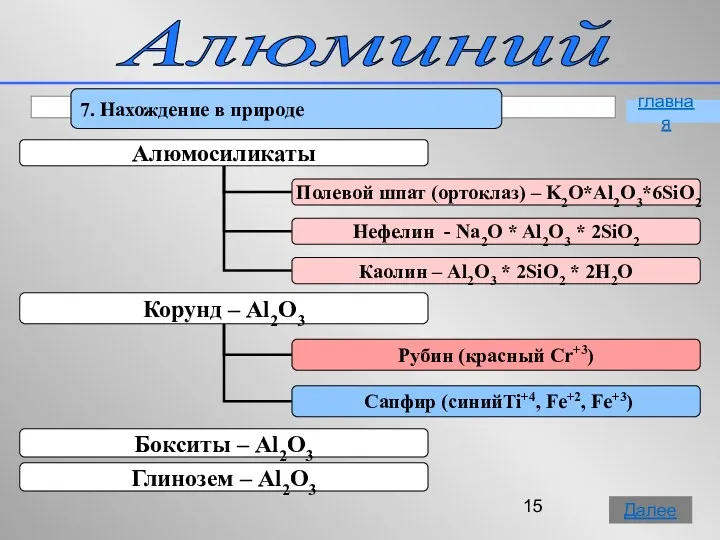
- 15. Алюминий 7. Нахождение в природе главная Далее
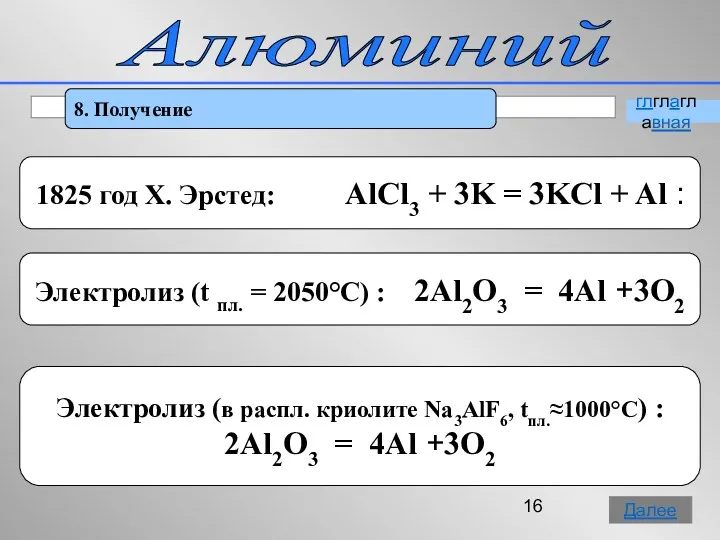
- 16. Алюминий 8. Получение глглаглавная Далее
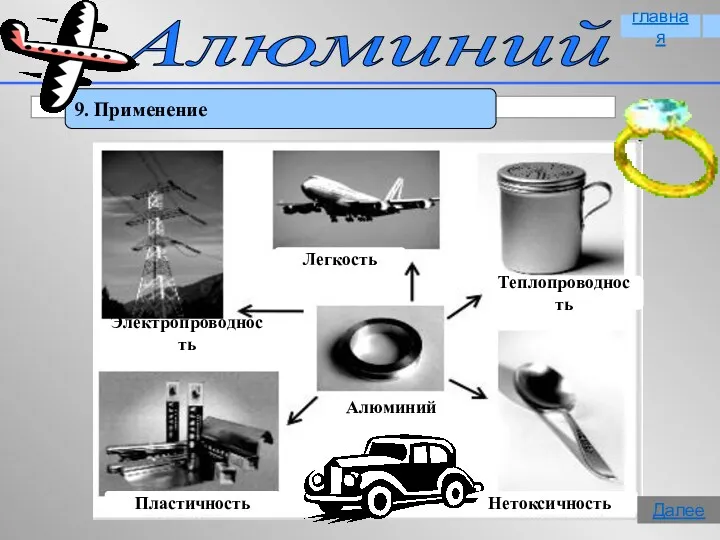
- 17. Алюминий 9. Применение главная Далее
- 19. Скачать презентацию






 ОВР в органической химии
ОВР в органической химии Ферментативный катализ, влияние давления, концентрации и катализаторов на скорость химической реакции
Ферментативный катализ, влияние давления, концентрации и катализаторов на скорость химической реакции Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Радиогеохимия метаморфических процессов
Радиогеохимия метаморфических процессов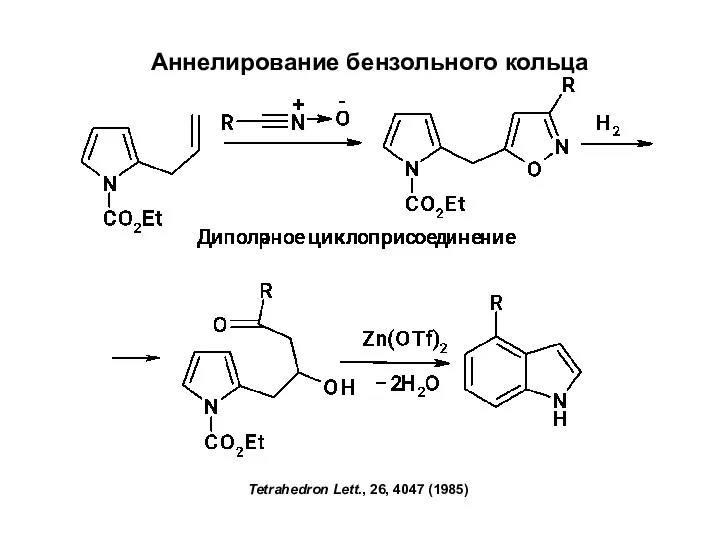 Аннелирование бензольного кольца
Аннелирование бензольного кольца Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Задачи на смеси и сплавы. Метод Пирсона
Задачи на смеси и сплавы. Метод Пирсона Хімія та обмін вуглеводів
Хімія та обмін вуглеводів Алюминий и его соединения
Алюминий и его соединения Выращивание кристаллов методом Чохральского
Выращивание кристаллов методом Чохральского Супутній нафтовий газ
Супутній нафтовий газ Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар Соли, как производные кислот и оснований. Их состав и номенклатура
Соли, как производные кислот и оснований. Их состав и номенклатура Сахар - вред или польза?
Сахар - вред или польза? Алюминий и его соединения
Алюминий и его соединения Жесткость воды. Способы ее устранения
Жесткость воды. Способы ее устранения Объёмная доля компонента смеси
Объёмная доля компонента смеси МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс
МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Различные теории кислот и оснований
Различные теории кислот и оснований Прочность полимеров
Прочность полимеров Оксиды и гидроксиды
Оксиды и гидроксиды Оксид углерода-С
Оксид углерода-С Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул Вещества молекулярного и немолекулярного строения
Вещества молекулярного и немолекулярного строения Физико-химические процессы в тропосфере. Температурные инверсии. Смог в атмосфере городов. Аэрозоли
Физико-химические процессы в тропосфере. Температурные инверсии. Смог в атмосфере городов. Аэрозоли