Содержание
- 2. Все вещества по способности в растворе или в расплавленном состоянии проводить электрический ток делят на две
- 3. 1. Электролитическая диссоциация. Теория Аррениуса и современные представления Окончательный вариант теории Аррениуса (1887) содержал три основные
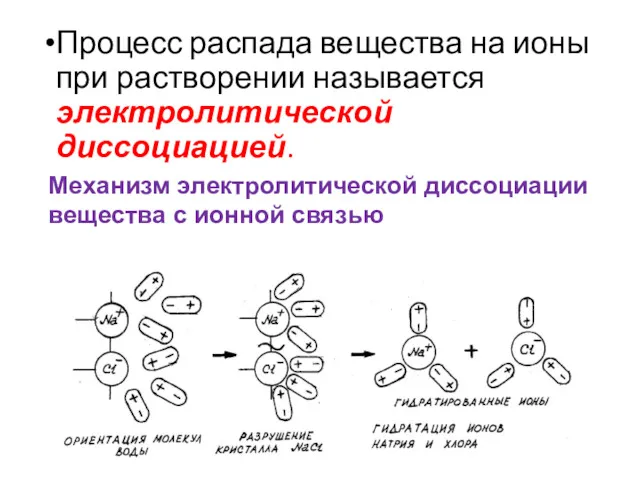
- 4. Процесс распада вещества на ионы при растворении называется электролитической диссоциацией. Механизм электролитической диссоциации вещества с ионной
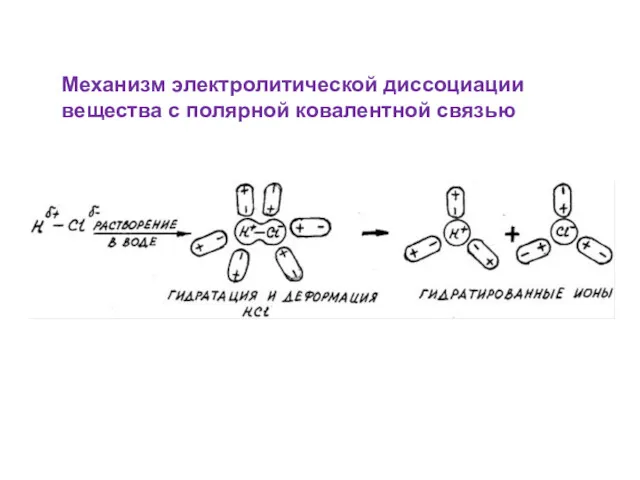
- 5. Механизм электролитической диссоциации вещества с полярной ковалентной связью
- 6. 2. Степень диссоциации. Сильные и слабые электролиты Cтепень электролитической диссоциации (α) - это количество распавшихся на
- 7. Степень электролитической диссоциации зависит от природы растворителя и растворяемого вещества, температуры и концентрации раствора: 1. Чем
- 8. По величине α различают: а) сильные электролиты α > 0,3 б) электролиты средней силы 0,03 в)
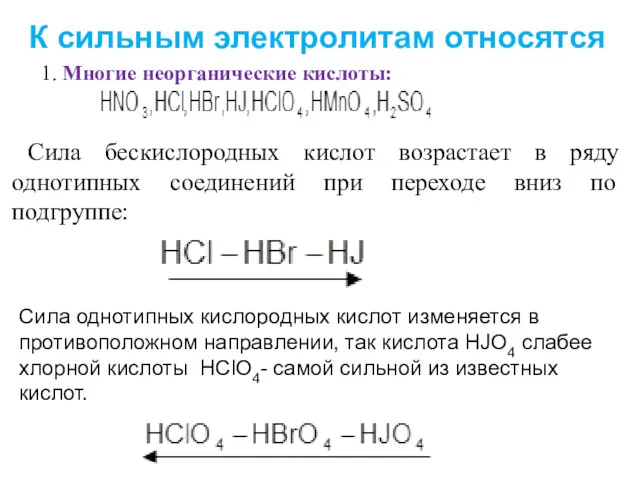
- 9. 1. Многие неорганические кислоты: Сила бескислородных кислот возрастает в ряду однотипных соединений при переходе вниз по
- 10. Если элемент образует несколько кислородных кислот, то наибольшей силой обладает кислота, в которой элемент имеет наибольшую
- 11. 2.Гидроксиды щелочных и щелочно-земельных металлов: При переходе вниз по подгруппе по мере усиления металлических свойств элементов
- 12. К слабым электролитам относятся 1. Органические кислоты, а также неорганические кислоты, вода Многокислотные слабые основания, т.е.
- 13. 2. Основания: неорганические и органические, например NH4OH (водный раствор аммиака), Mg(OH)2, CH3NH2. Основные свойства гидроксидов одного
- 14. 3. Некоторые соли, проявляя свойства слабых электролитов, диссоциируют обратимо и в несколько ступеней: К электролитам средней
- 15. 3. Сильные электролиты Основные положения теории сильных электролитов: В водных растворах сильные электролиты полностью диссоциированы, поэтому
- 16. * Для сильных электролитов: степень диссоциации – кажущаяся αкаж αкаж ≠ 100 % α ↑ с
- 17. Ионная сила раствора Поведение иона в растворе сильного электролита характеризуется некоторой функцией от концентрации электролита, которая
- 18. Если в растворе содержатся только однозарядные ионы бинарного электролита, то ионная сила раствора численно равна молярности
- 19. Активность ионов — эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от
- 20. * Коэффициент активности связан с ионной силой соотношением: где z – заряд иона, f – коэффициент
- 21. Пример: диссоциация уксусной кислоты СН3СООН=СН3СОО– + Н+ В водном растворе устанавливается равновесие которое количественно характеризуется константой
- 22. Обозначим концентрации каждого из ионов: а концентрацию СH3COOH:
- 23. Тогда константа диссоциации: где С – молярная концентрация электролита. Для слабого электролита Кд – величина постоянная
- 24. - это закон разбавления Оствальда для слабых электролитов Для слабых электролитов α Кд = α2С α
- 25. * Свойства растворов электролитов (ΔP, ΔTкип, ΔТзам, РОСМ) отличаются в i раз от неэлектролитов i –
- 26. * В общем виде: КnAm⇄n⋅Km++m⋅An- - связь i и α n – max число ионов, на
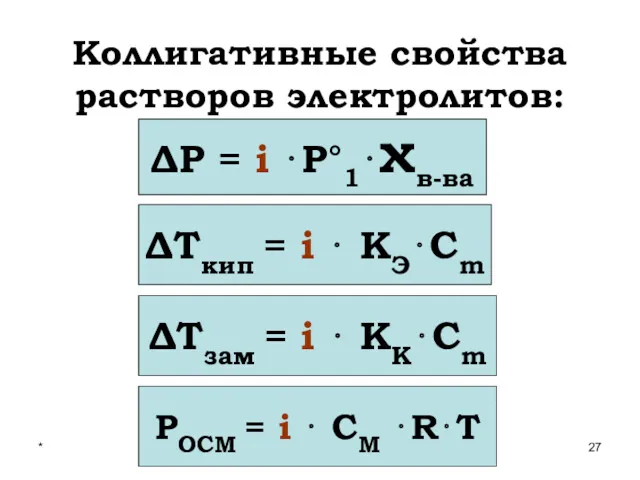
- 27. * Коллигативные свойства растворов электролитов: ΔР = i ⋅Р°1⋅χв-ва ΔТкип = i ⋅ КЭ⋅Сm ΔТзам =
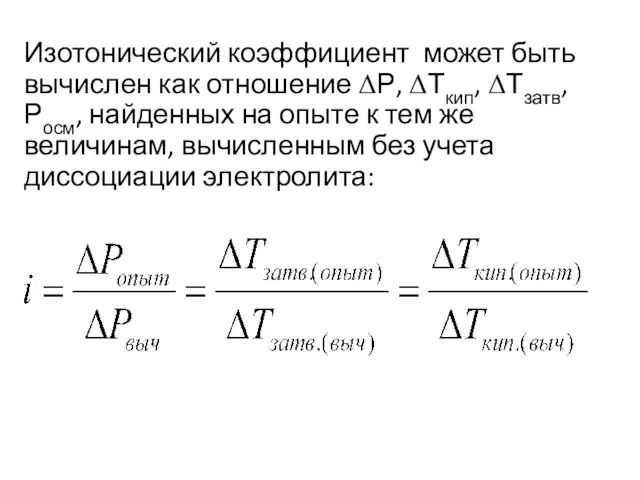
- 28. Изотонический коэффициент может быть вычислен как отношение ΔР, ΔТкип, ΔТзатв, Росм, найденных на опыте к тем
- 29. Вопросы для самостоятельного повторения: Электропроводность растворов электролитов. Удельная электропроводность. Эквивалентная электропроводность. Влияние различных факторов на удельную
- 31. Скачать презентацию

















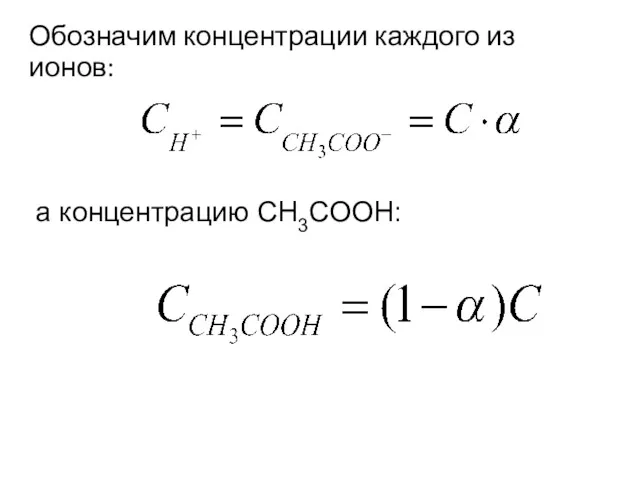





 Кристаллические решётки и их виды
Кристаллические решётки и их виды Enantioselective Total Synthesis
Enantioselective Total Synthesis Химические свойства солей
Химические свойства солей Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Группа ультраосновных пород
Группа ультраосновных пород Строение атома
Строение атома Серная кислота
Серная кислота 20230419_izomery
20230419_izomery Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату kremniy
kremniy Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Типы химических реакций. Систематизация и обобщение знаний
Типы химических реакций. Систематизация и обобщение знаний Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Методы получения органических галогенидов
Методы получения органических галогенидов Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном
Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном Химия аминокислот. Лекция № 4
Химия аминокислот. Лекция № 4 Стратегия химической промышленности
Стратегия химической промышленности Вещества
Вещества Химия 20 века
Химия 20 века Газовые смеси
Газовые смеси Правила техники безопасности при работе в химическом кабинете
Правила техники безопасности при работе в химическом кабинете Формы парфюмерно-косметической продукции
Формы парфюмерно-косметической продукции Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Создание косметических средств
Создание косметических средств Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Металлы в природе. Способы получения металлов
Металлы в природе. Способы получения металлов