Содержание
- 2. 1) Что называют химической реакцией? 2) По каким признакам можно утверждать, что произошла или происходит химическая
- 3. «Теория проверяется практикой». Ученический эксперимент №1: «Карбонат кальция + серная кислота = сульфат кальция + оксид
- 6. Игра «Третий лишний» В каждом столбце найдите «лишнее» УХР, используя знания о химических реакциях ОВР и
- 7. Окислитель – атомы, ионы или молекулы, принимающие электроны Восстановитель - атомы, ионы или молекулы, отдающие электроны
- 8. Задание: Выберите из предложенных уравнений термохимические уравнения. а) CaCO3 = CaO + CO2↑-Q б) CaCO3 =
- 9. Ключ к «Лабиринту» 1 ?2 ? 7 ? 8 ? 4 ? 3 ? 6 ?
- 11. Скачать презентацию








 Ионная связь и степень окисления. 8 класс
Ионная связь и степень окисления. 8 класс Химические волокна
Химические волокна Властивості та застосування полімерів
Властивості та застосування полімерів Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Характеристика неметаллов. Галогены
Характеристика неметаллов. Галогены Етери та естери
Етери та естери Анилин. Строение. Физические и химические свойства
Анилин. Строение. Физические и химические свойства Загадки минералов. 7 класс
Загадки минералов. 7 класс Сложные эфиры. Жиры
Сложные эфиры. Жиры Амины, анилин: строение, свойства, получение, применение
Амины, анилин: строение, свойства, получение, применение Химические волокна
Химические волокна Изучение физико-химических свойств мицеллярных растворов индивидуальных ПАВ, композиций различных ПАВ
Изучение физико-химических свойств мицеллярных растворов индивидуальных ПАВ, композиций различных ПАВ Метаболизм жирных кислот
Метаболизм жирных кислот Угольная и кремниевая кислоты и их соли
Угольная и кремниевая кислоты и их соли Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини
Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини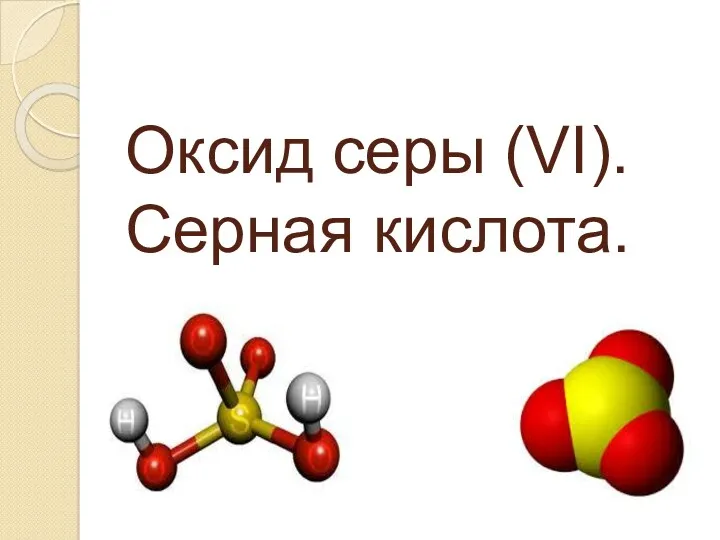 Оксид серы (VI). Серная кислота
Оксид серы (VI). Серная кислота Строение атома. Планетарная модель Резерфорда
Строение атома. Планетарная модель Резерфорда Дисперсные системы
Дисперсные системы Неметаллы VА группы
Неметаллы VА группы Теоретические аспекты
Теоретические аспекты Состав и свойства сжиженного газа. Вопрос №1
Состав и свойства сжиженного газа. Вопрос №1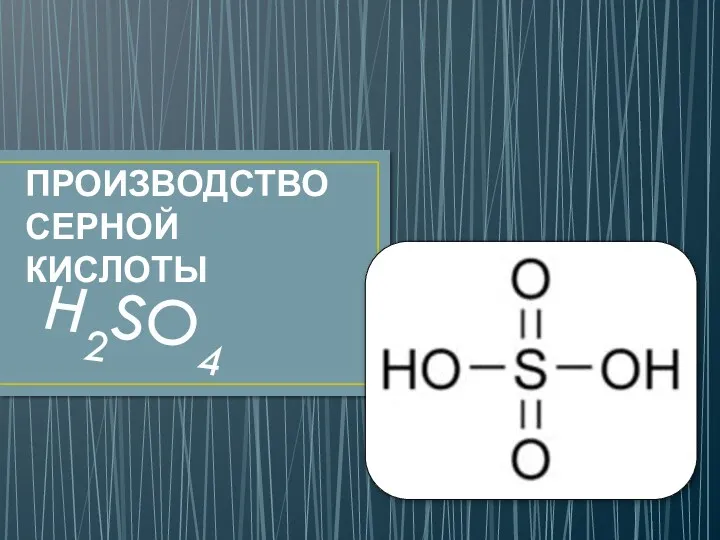 Производство серной кислоты
Производство серной кислоты Признаки химических реакций. (Практическая работа 5,4)
Признаки химических реакций. (Практическая работа 5,4) An introduction to the chemistry of alkenes
An introduction to the chemistry of alkenes Общая геология. Породообразующие минералы
Общая геология. Породообразующие минералы Генетическая взаимосвязь органических веществ. Задание 38
Генетическая взаимосвязь органических веществ. Задание 38 Этимология химических элементов
Этимология химических элементов Циклические углеводороды
Циклические углеводороды