Содержание
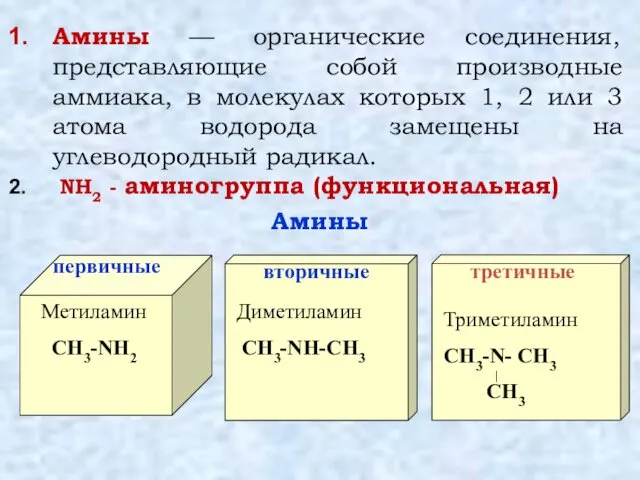
- 2. Амины — органические соединения, представляющие собой производные аммиака, в молекулах которых 1, 2 или 3 атома
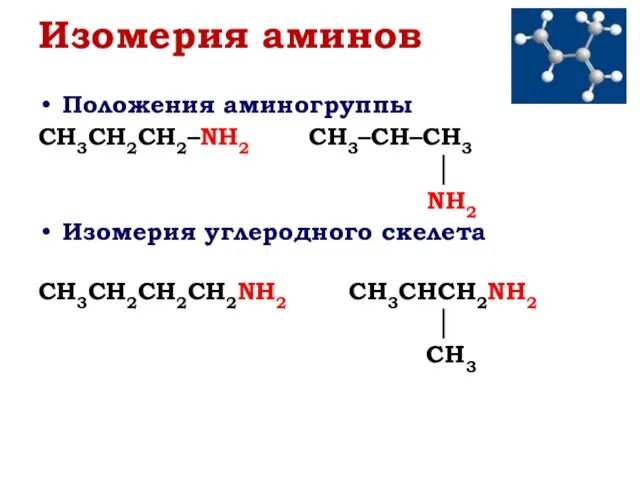
- 3. Изомерия аминов Положения аминогруппы CH3CH2CH2–NH2 CH3–CH–CH3 │ NH2 Изомерия углеродного скелета CH3CH2CH2CH2NH2 CH3CHCH2NH2 │ CH3
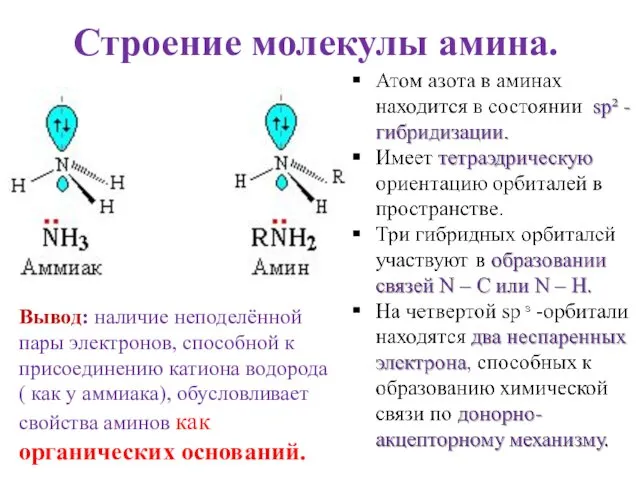
- 4. Строение молекулы амина. Вывод: наличие неподелённой пары электронов, способной к присоединению катиона водорода ( как у
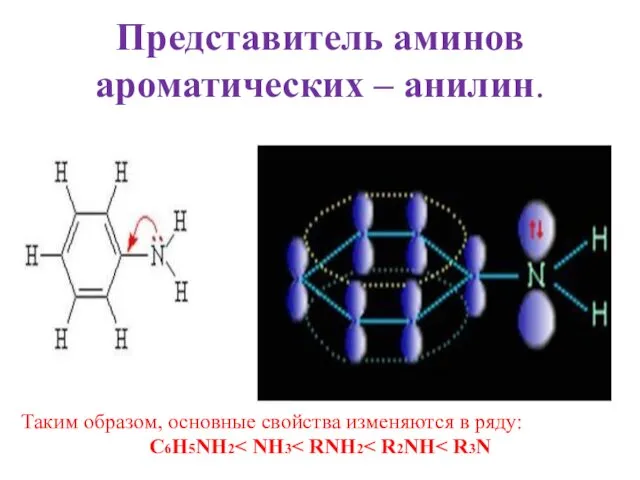
- 5. Представитель аминов ароматических – анилин. Таким образом, основные свойства изменяются в ряду: C6H5NH2
- 6. Физические свойства Простейшие амины (метиламин, диметиламин, триметиламин) – газообразные вещества. Остальные низшие амины – жидкости, которые
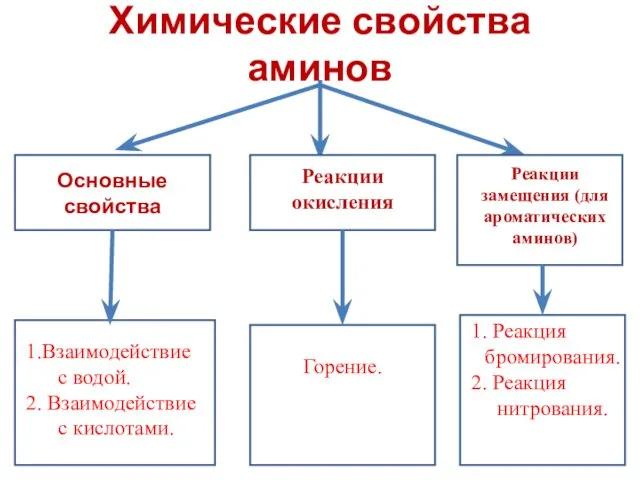
- 7. Химические свойства аминов Основные свойства Реакции окисления Реакции замещения (для ароматических аминов) 1.Взаимодействие с водой. 2.
- 8. Химические свойства 1. Амины как основания. Атом азота аминогруппы за счет неподеленной пары электронов может образовывать
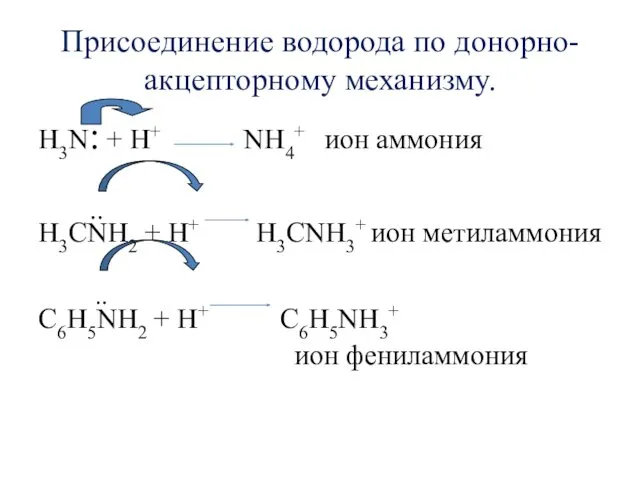
- 9. Присоединение водорода по донорно-акцепторному механизму. H3N: + H+ NH4+ ион аммония .. H3CNH2 + H+ H3CNH3+
- 10. Основное свойство аминов (взаимодействие с кислотами) H3CNH2 + HCl [CH3NH3]+Cl- хлорид метиламмония C6H5NH2 + HCl [C6H5NH3]+Cl-
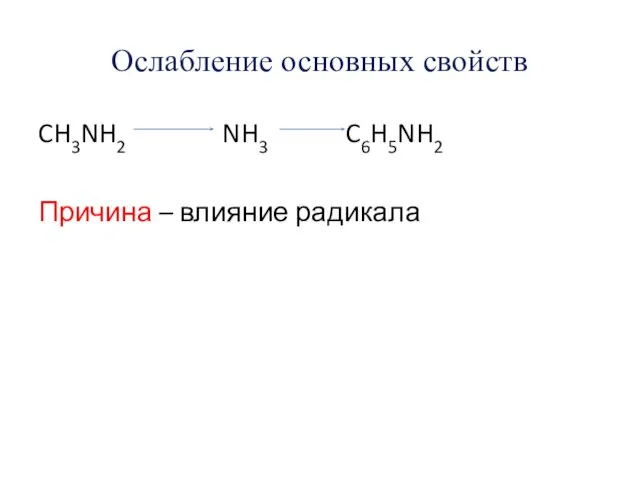
- 11. Ослабление основных свойств CH3NH2 NH3 C6H5NH2 Причина – влияние радикала
- 12. Реакция окисления. Амины горят. На воздухе с образованием углекислого газа, воды и азота:
- 13. Амины вступают в реакцию нуклеофильного замещения. Выступая в роли нуклеофилов:
- 14. Амины взаимодействуют с производными карбоновых кислот (сложными эфирами, хлорангидридами, ангидридами). Образуя Амиды – важнейший класс органических
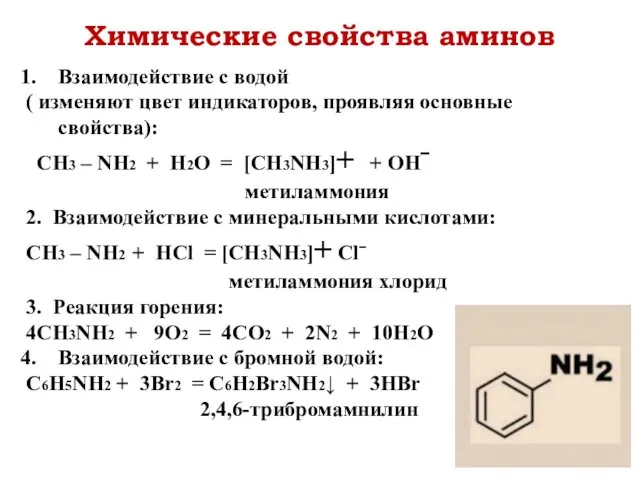
- 15. Химические свойства аминов Взаимодействие с водой ( изменяют цвет индикаторов, проявляя основные свойства): CH3 – NH2
- 16. Получение аминов 1 способ 2 способ 3 способ
- 17. Получение аминов 4 способ !При реакции Гофмана группа (Ar) R: мигрирует от атома углерода к соседнему
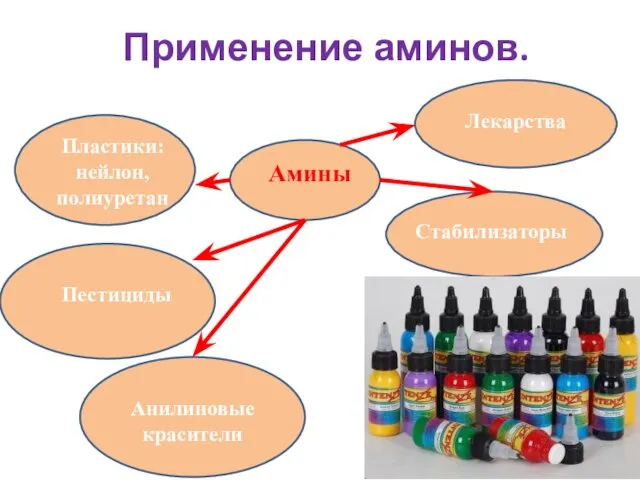
- 18. Применение аминов. Амины Пластики: нейлон, полиуретан Анилиновые красители Пестициды Стабилизаторы Лекарства
- 19. Нахождение аминов в природе В свободном состоянии простые амины редко встречаются в природе. Амины образуются при
- 20. Ряд аминов образуются в организмах растений и животных в результате биохимического распада аминокислот под действием ферментов
- 21. Серотонин является химическим передатчиком импульсов между нервными клетками человеческого мозга и контролирует аппетит, сон, настроение и
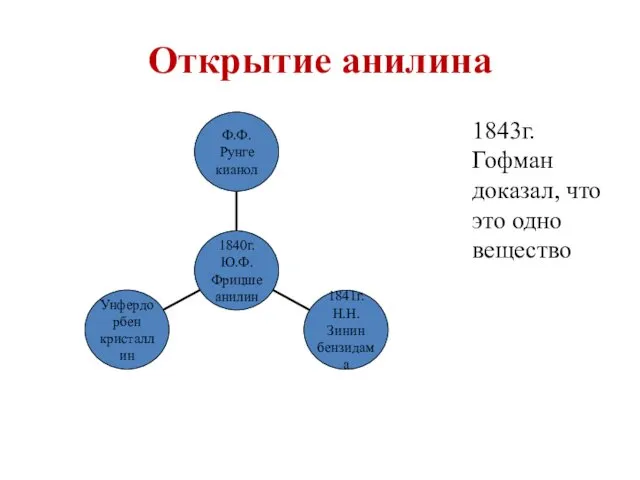
- 22. Открытие анилина 1843г. Гофман доказал, что это одно вещество
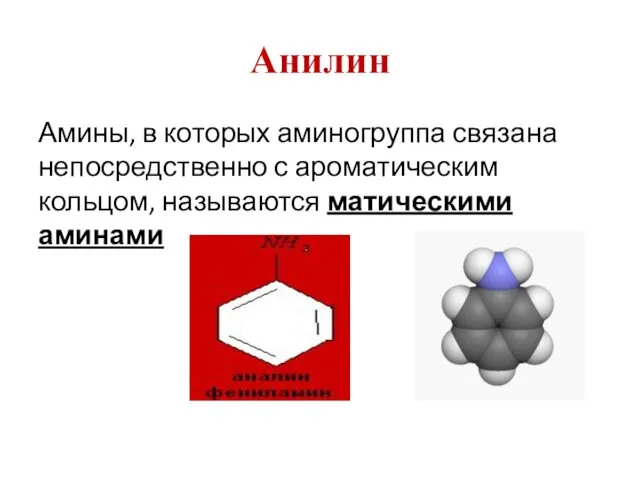
- 23. Анилин Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются матическими аминами
- 25. Физические свойства Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т.
- 26. Свойства анилина 1. Анилин - гораздо более слабое основание, чем алифатические амины (Kb = 5,2.10-10). Это
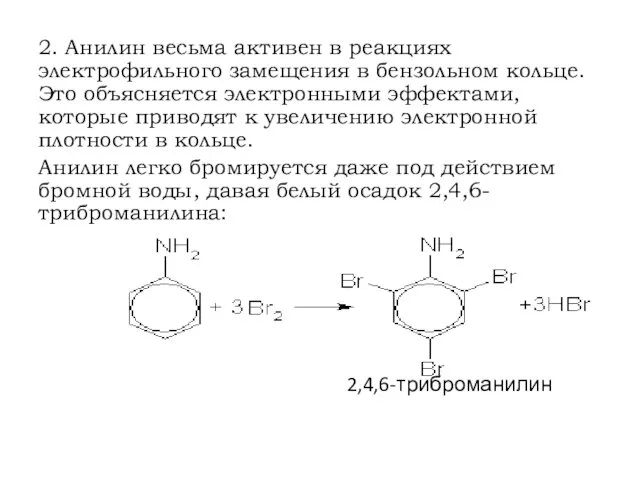
- 27. 2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые
- 28. 3. При реакции анилина с азотистой кислотой образуются диазосоединения — соли диазония C6H5N2+: C6H5NH2 + NaNO2
- 30. Скачать презентацию


![Основное свойство аминов (взаимодействие с кислотами) H3CNH2 + HCl [CH3NH3]+Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/24158/slide-9.jpg)












 Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Химическая связь
Химическая связь Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 большая стирка
большая стирка Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Химическая связь
Химическая связь Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату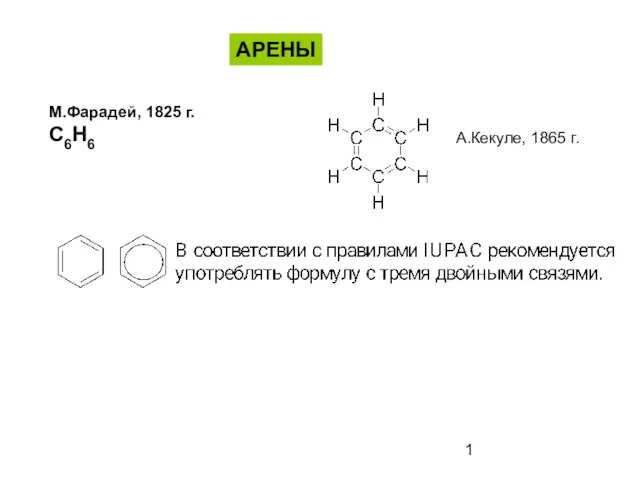 Ароматические соединения - арены
Ароматические соединения - арены Водородная связь
Водородная связь Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Азот и его соединения
Азот и его соединения Технология оптического стекла
Технология оптического стекла Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Электрохимические процессы
Электрохимические процессы Простые вещества
Простые вещества Кислород
Кислород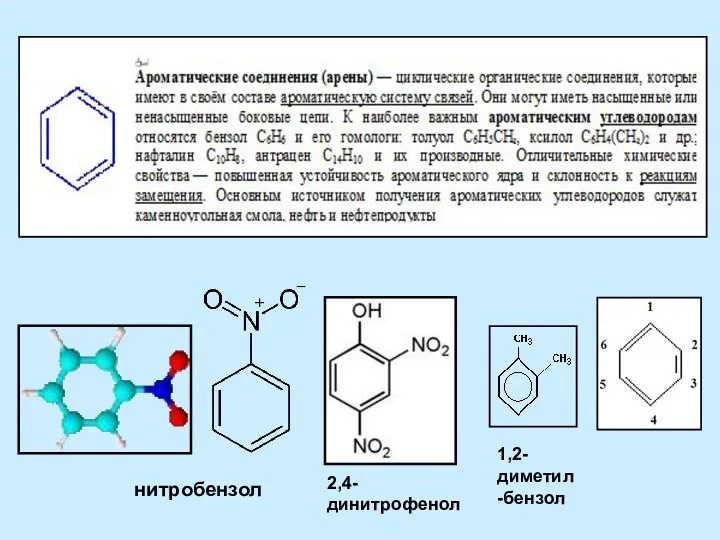 Ароматические соединения (арены)
Ароматические соединения (арены) Алкалоидтар
Алкалоидтар Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Химия в строительстве
Химия в строительстве Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Углерод
Углерод