Содержание
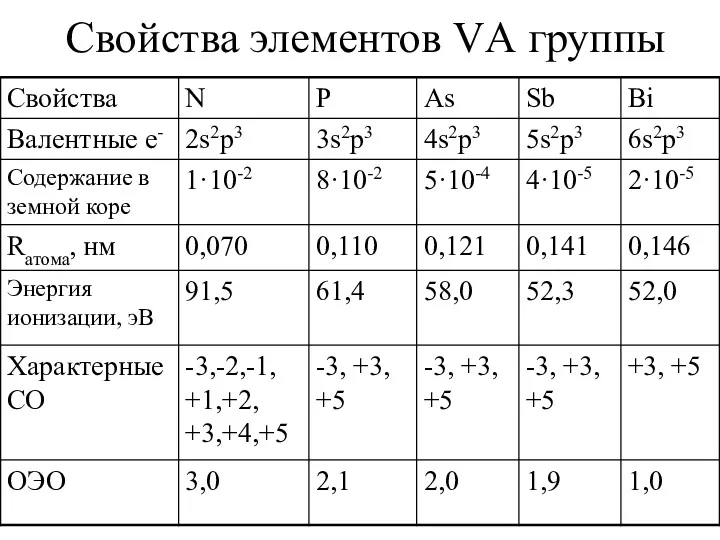
- 2. Свойства элементов VА группы
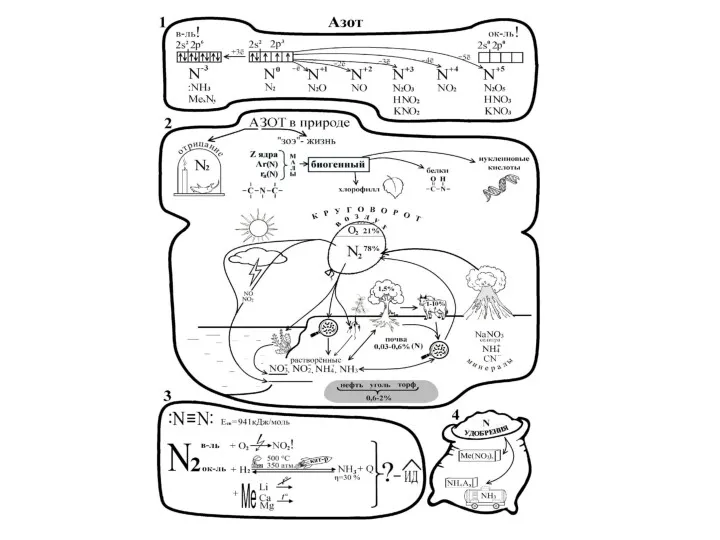
- 3. Степени окисления азота
- 4. Азот Нахождение в природе: 78% V воздуха –N2, селитры- чилийская(NaNO3), индийская (KNO3), норвежская [Ca(NO3)2], в живых
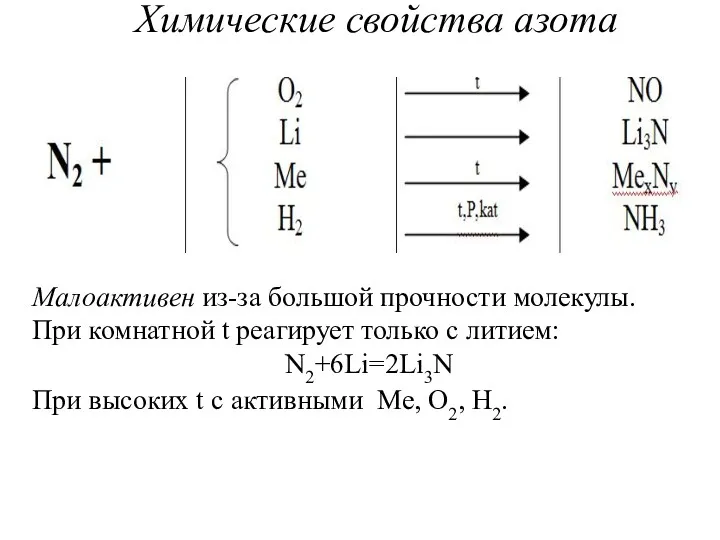
- 5. Химические свойства азота Малоактивен из-за большой прочности молекулы. При комнатной t реагирует только с литием: N2+6Li=2Li3N
- 6. Аммиак NH3- бесцветный газ с характерным запахом «нашатырного спирта», легче воздуха, хорошо растворим в воде (1v
- 7. Химические свойства аммиака Водный раствор – слабое основание (Кд=1,8 ·10-5) NH3(г)+H2O⮀ NH4OH⮀ NH4++OH-. NH3+HCl⮀ NH4Cl (белый
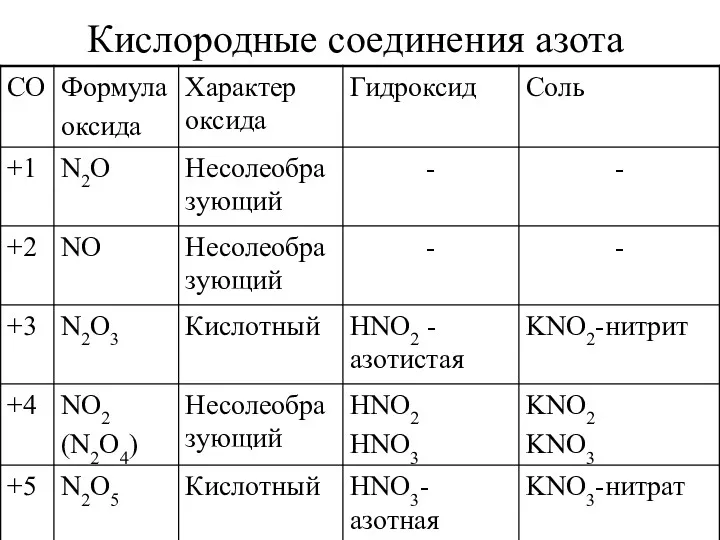
- 8. Кислородные соединения азота
- 9. Оксиды азота N2O – «веселящий газ» бесцветный газ с приятным запахом и сладковатым вкусом, оказывает опьяняющее
- 10. NO – бесцветный газ растворимый в воде, но не реагирующий с ней. Получение: 3Cu+8HNO3(разб)=3Cu(NO3)2+2NO+4H2O. В промышленности:
- 11. NO2- бурый газ, обладающий характерным запахом, раздражает дыхательные пути, очень ядовит. Молекула – радикал с одним
- 12. Соединения азота в СО +5 N2O5 – азотный ангидрид – бесцветные взрывчатые кристаллы с ионной структурой,
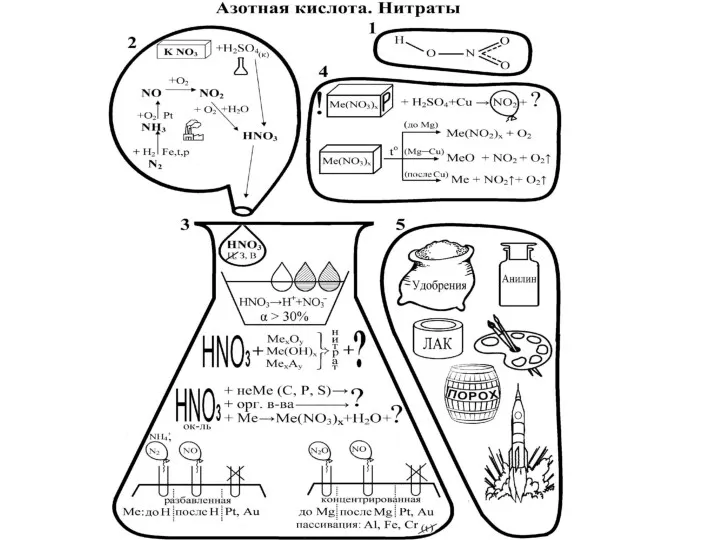
- 13. Получение азотной кислоты HNO3 (чистая) – бесцветная летучая жидкость с едким запахом. Концентрированная имеет бурую окраску,
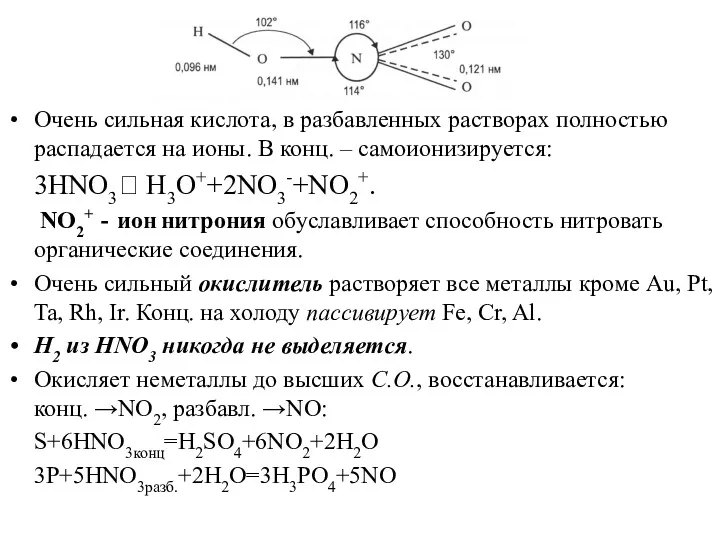
- 14. Очень сильная кислота, в разбавленных растворах полностью распадается на ионы. В конц. – самоионизируется: 3HNO3⮀ H3O++2NO3-+NO2+.
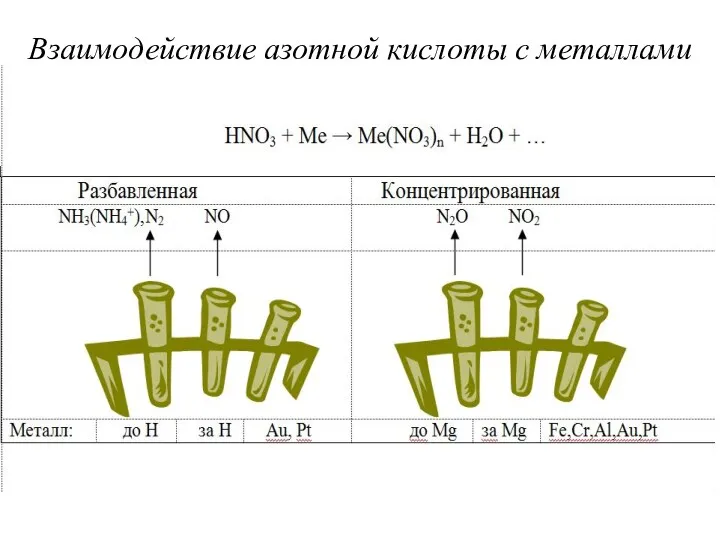
- 15. Взаимодействие азотной кислоты с металлами
- 16. Соли азотной кислоты - нитраты (селитры) хорошо растворимы в воде. При нагревании разлагаются с выделением О2.
- 17. Применение азота и его соединений N2- жидкий для охлаждения, газ – для синтеза NH3, HNO3 и
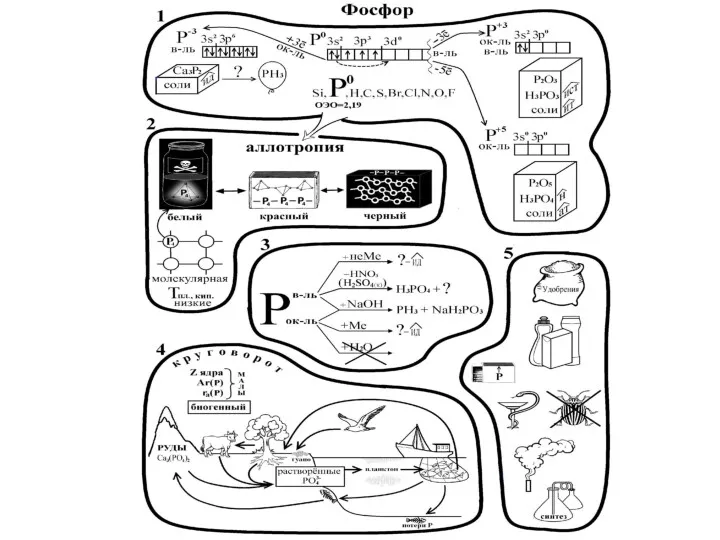
- 18. Фосфор Нахождение в природе: фосфорит – Ca3(PO4)2, фторапатит - Ca 5(PO4)3F , в белках и нуклеиновых
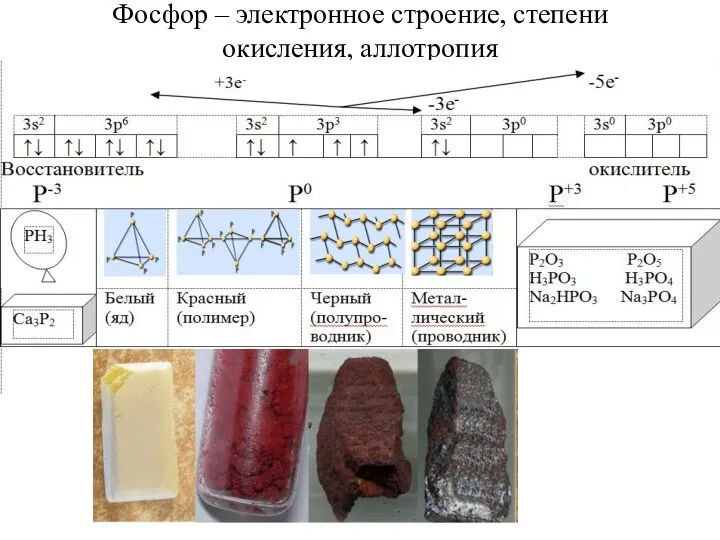
- 19. Фосфор – электронное строение, степени окисления, аллотропия
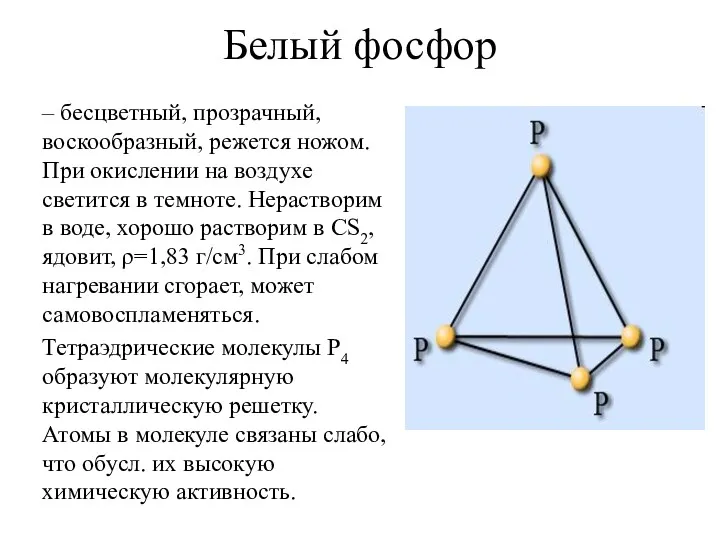
- 20. Белый фосфор – бесцветный, прозрачный, воскообразный, режется ножом. При окислении на воздухе светится в темноте. Нерастворим
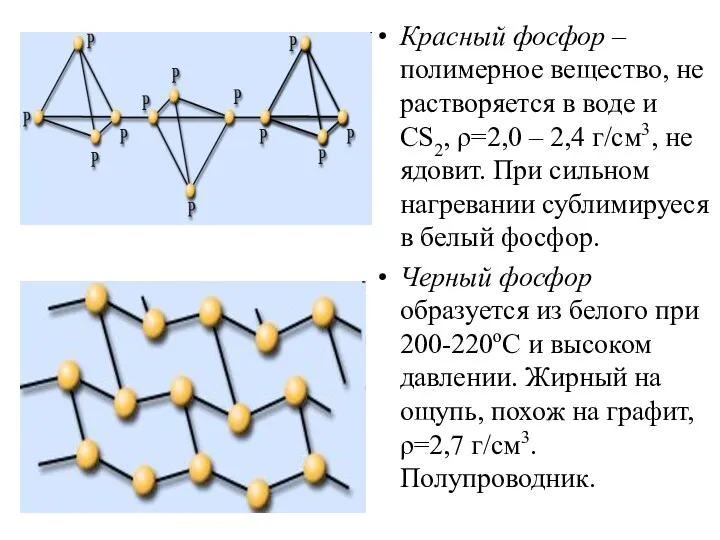
- 21. Красный фосфор – полимерное вещество, не растворяется в воде и CS2, ρ=2,0 – 2,4 г/см3, не
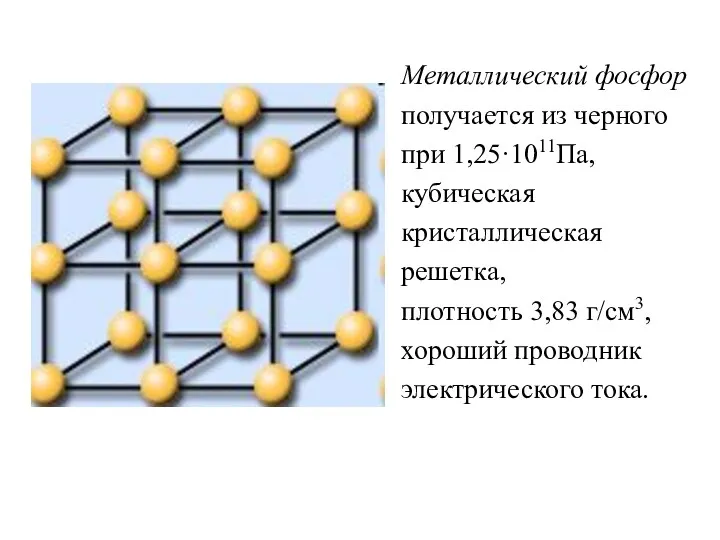
- 22. Металлический фосфор получается из черного при 1,25·1011Па, кубическая кристаллическая решетка, плотность 3,83 г/см3, хороший проводник электрического
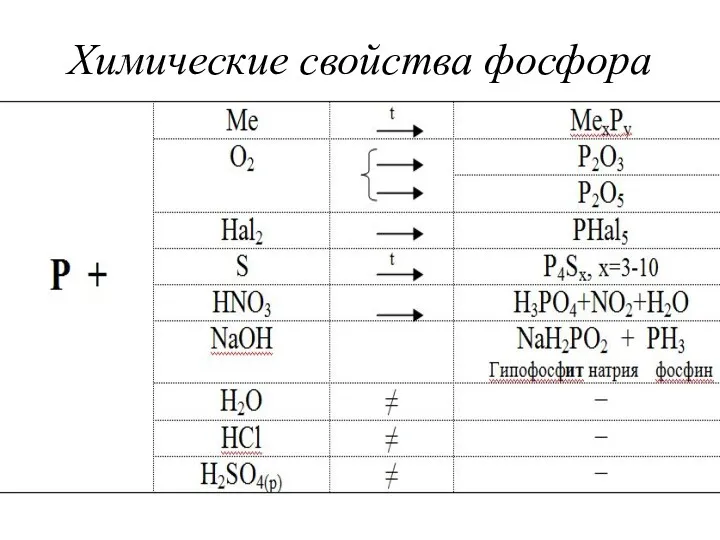
- 23. Химические свойства фосфора
- 24. Соединения фосфора P3-H3 - фосфин – ядовитый газ с чесночным запахом. Сильный восстановитель, на воздухе самовоспламеняется:
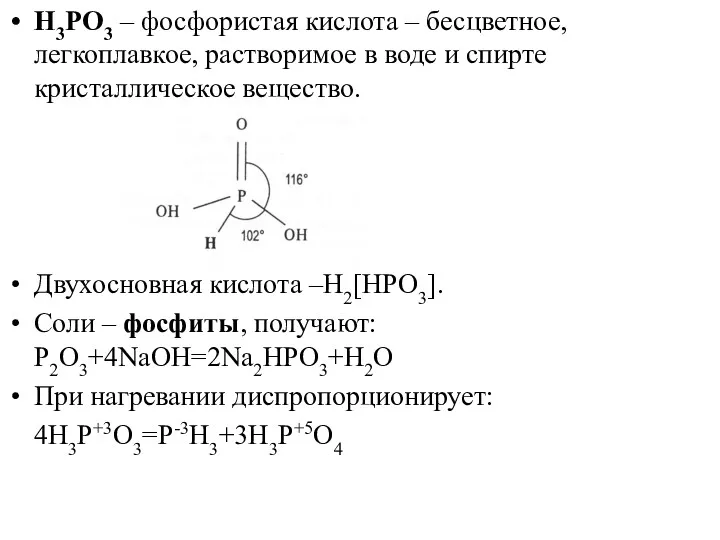
- 25. H3PO3 – фосфористая кислота – бесцветное, легкоплавкое, растворимое в воде и спирте кристаллическое вещество. Двухосновная кислота
- 26. Соединения фосфора в С.О +5 P4O10 (P2O5) – белая снегообразная масса. Образуется при горении фосфора на
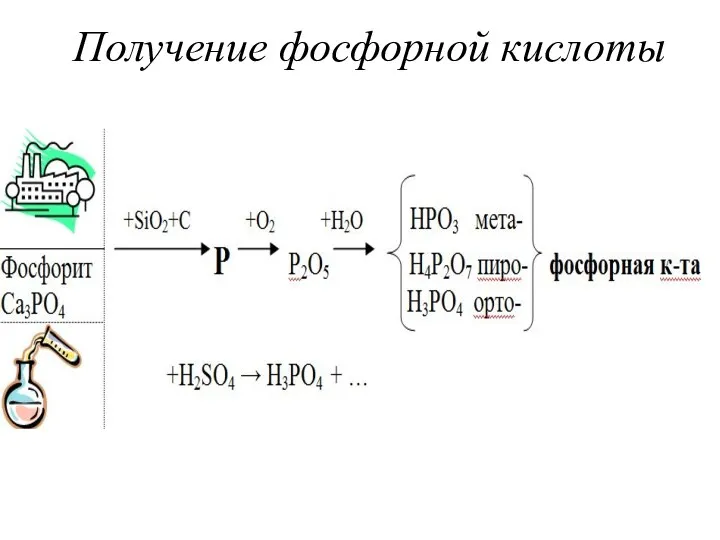
- 27. Получение фосфорной кислоты
- 28. Соли ортофосфорной кислоты Растворимые ортофосфаты гидролизуются: Na3PO4 + H2O = NaOH + Na2HPO4 PO43- + HOH
- 29. Применение фосфора и его соединений P – в производстве спичек, для получения P4O10 , H3PO4, в
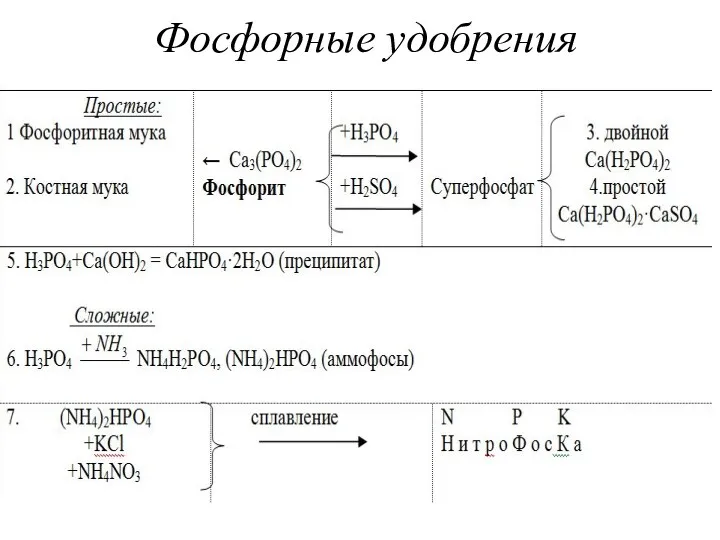
- 30. Фосфорные удобрения
- 35. Скачать презентацию
















 Кристаллохимия негіздері
Кристаллохимия негіздері Карбонаты
Карбонаты Imperfections in Solids
Imperfections in Solids Полисахариды. Крахмал Целлюлоза. 10 класс
Полисахариды. Крахмал Целлюлоза. 10 класс Подгруппа углерода
Подгруппа углерода Феноли (бензенол)
Феноли (бензенол) Water
Water Қышқылдық-негіздік тепе-теңдік. Қышқылдар мен негіздердің протологиялық теориясы
Қышқылдық-негіздік тепе-теңдік. Қышқылдар мен негіздердің протологиялық теориясы Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Алкины
Алкины Номенклатура органических соединений
Номенклатура органических соединений Кристаллы и минералы
Кристаллы и минералы Химия и сельское хозяйство
Химия и сельское хозяйство Закон сохранения массы веществ
Закон сохранения массы веществ Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Аминдердің химиялық қасиеттері
Аминдердің химиялық қасиеттері Химическая технология ситаллов и композитов
Химическая технология ситаллов и композитов Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ
Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода Элемент свинец Рb
Элемент свинец Рb Оксид фосфора P2O5
Оксид фосфора P2O5 Водород. Химические свойства
Водород. Химические свойства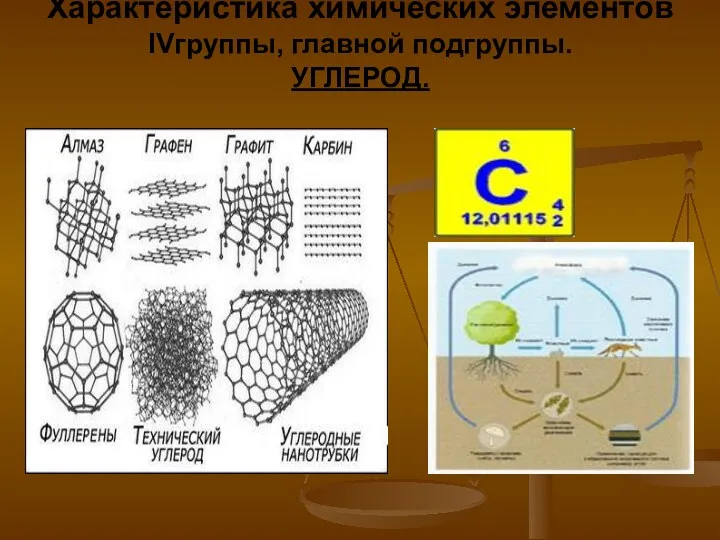 Характеристика химических элементов IV группы, главной подгруппы. Углерод
Характеристика химических элементов IV группы, главной подгруппы. Углерод Көмірсулар. Моносахаридтер. Жіктелуі. Гексозалар. Құрылысы
Көмірсулар. Моносахаридтер. Жіктелуі. Гексозалар. Құрылысы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Дипломная работа. Тема: Получение гальванических покрытий на основе цинка
Дипломная работа. Тема: Получение гальванических покрытий на основе цинка Галогены в природе. Хлор, бром, иод
Галогены в природе. Хлор, бром, иод