Содержание
- 2. Механизм SN1 (мономолекулярный) включает две стадии: диссоциация алкилгалогенида на ионы и взаимодействие катиона с нуклеофилом; во
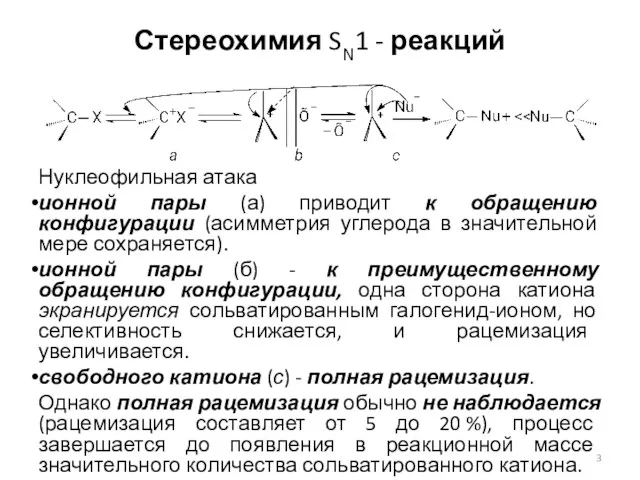
- 3. Стереохимия SN1 - реакций Нуклеофильная атака ионной пары (а) приводит к обращению конфигурации (асимметрия углерода в
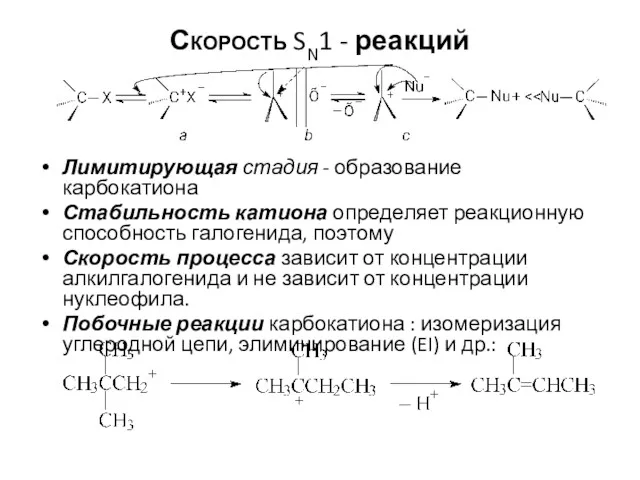
- 4. Скорость SN1 - реакций Лимитирующая стадия - образование карбокатиона Стабильность катиона определяет реакционную способность галогенида, поэтому
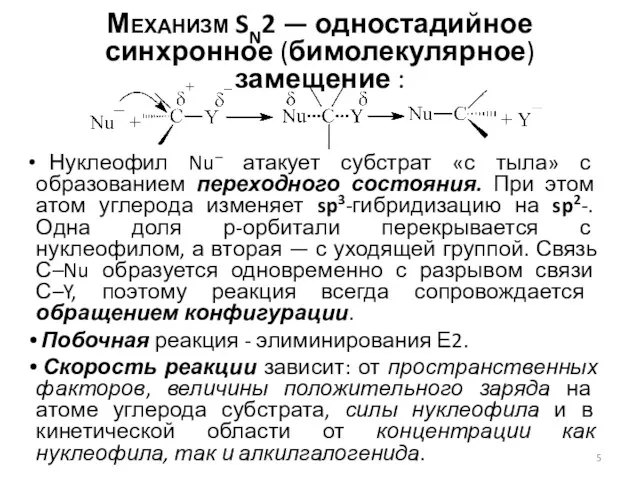
- 5. Механизм SN2 — одностадийное синхронное (бимолекулярное) замещение : Нуклеофил Nu– атакует субстрат «с тыла» с образованием
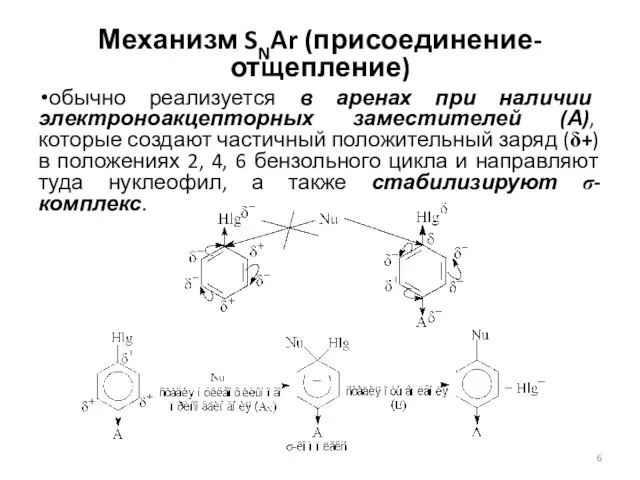
- 6. Механизм SNAr (присоединение-отщепление) обычно реализуется в аренах при наличии электроноакцепторных заместителей (А), которые создают частичный положительный
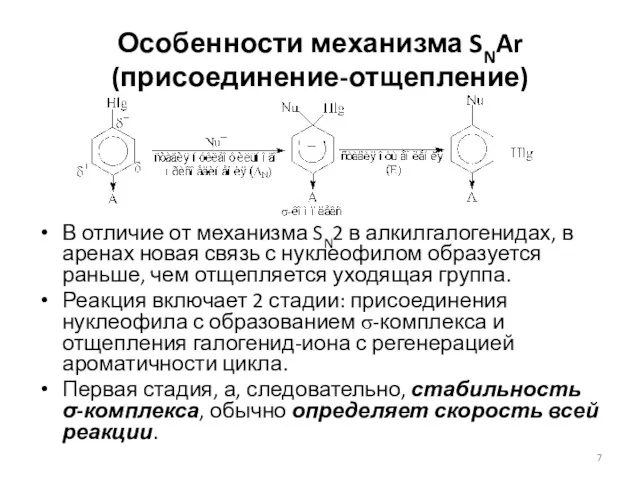
- 7. Особенности механизма SNAr (присоединение-отщепление) В отличие от механизма SN2 в алкилгалогенидах, в аренах новая связь с
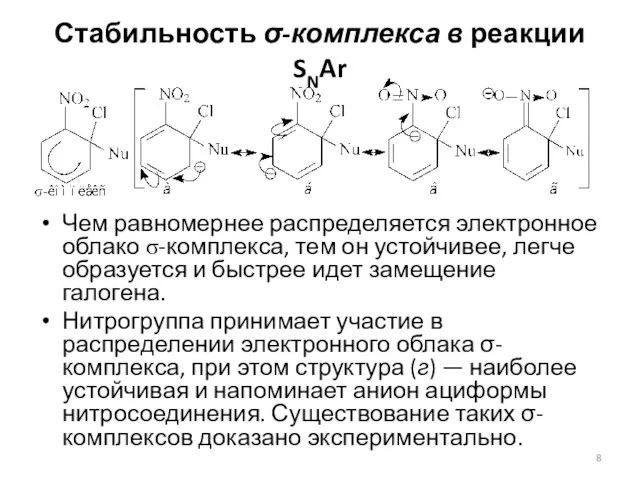
- 8. Стабильность σ-комплекса в реакции SNAr Чем равномернее распределяется электронное облако σ-комплекса, тем он устойчивее, легче образуется
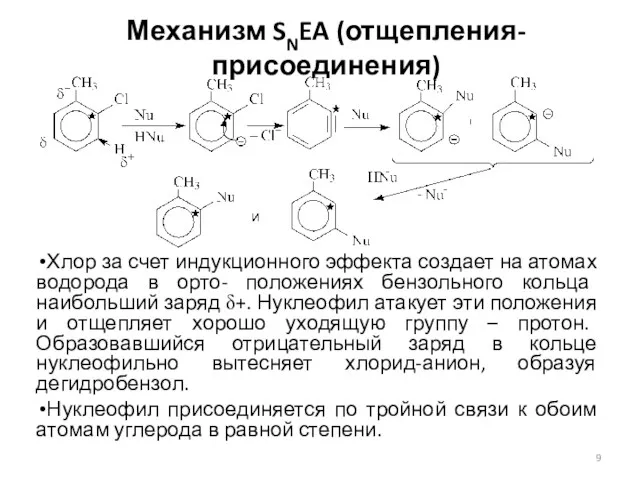
- 9. Механизм SNEA (отщепления-присоединения) Хлор за счет индукционного эффекта создает на атомах водорода в орто- положениях бензольного
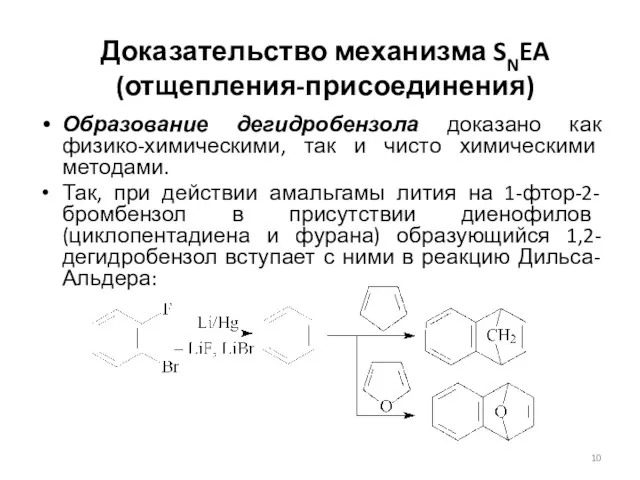
- 10. Доказательство механизма SNEA (отщепления-присоединения) Образование дегидробензола доказано как физико-химическими, так и чисто химическими методами. Так, при
- 11. Влияние строения алифатического субстрата на механизм замещения галогена Увеличение разветвленности радикала создаёт стерические препятствия для прямой
- 12. Влияние аллил- и бензилгалогенидов на механизм замещения галогена Первичные аллил- и бензилгалогениды образуют очень устойчивые карбокатионы
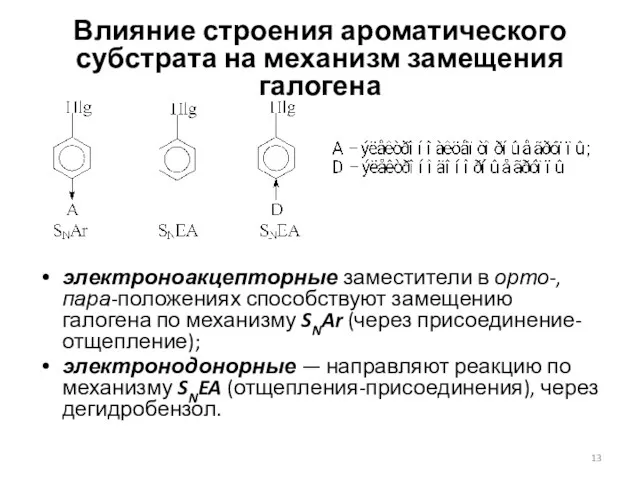
- 13. Влияние строения ароматического субстрата на механизм замещения галогена электроноакцепторные заместители в орто-, пара-положениях способствуют замещению галогена
- 14. Влияние строения алифатического субстрата на скорость SN1 реакции - Скорость SN1 реакции алкилгалогенидов возрастает по мере
- 15. Влияние строения алифатического субстрата на скорость SN2 реакции Скорость SN2 реакции алкилгалогенидов возрастает в прямо противоположном
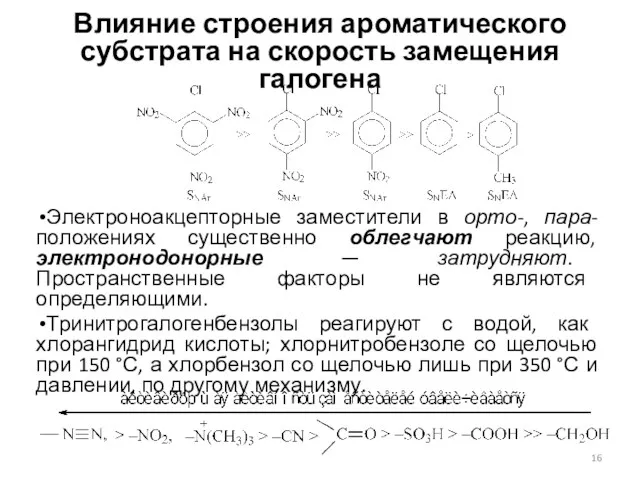
- 16. Влияние строения ароматического субстрата на скорость замещения галогена Электроноакцепторные заместители в орто-, пара-положениях существенно облегчают реакцию,
- 17. Влияние галогена на реакционную способность галогенидов - Галоген является уходящей группой и акцептором электронов. Способность галогена
- 18. Влияние нуклеофила на реакцию чем выше нуклеофильность (активность) реагента, тем вероятнее механизм SN2, слабые нуклеофилы способствуют
- 19. Влияние растворителя на нуклеофильное замещение - столь велико, что часто определяет механизм реакции. Полярные протонные растворители
- 20. Выбор растворителя для SN2 реакции Необходимо учитывать: распределение зарядов в переходном состоянии. Если оно полярнее исходных
- 21. Использование катализаторов Катализаторами SN1 реакций являются кислоты Льюиса и ион серебра, которые стабилизируют анионы. Катион стабилизируется
- 22. Нуклеофильное замещение гидроксильной группы Замещение гидроксила в спиртах, как и галогена у sp3-гибридного атома углерода обычно
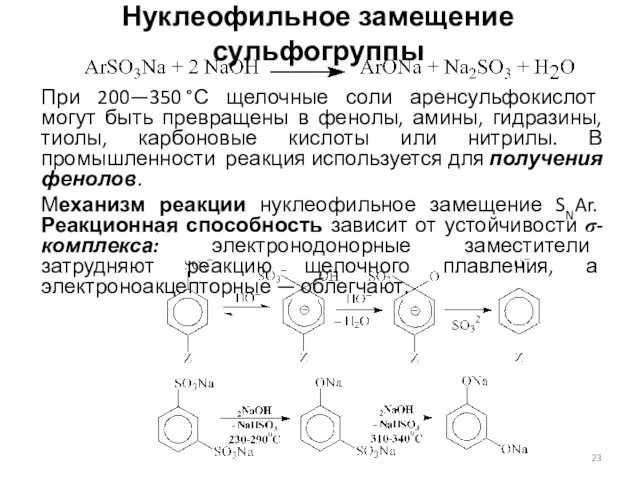
- 23. Нуклеофильное замещение сульфогруппы При 200—350 °С щелочные соли аренсульфокислот могут быть превращены в фенолы, амины, гидразины,
- 24. Самостоятельно Гидролиз галогенидов Получение простых эфиров Получение тиоспиртов, тиоэфиров Получение аминов Получение цианидов Получение сульфокислот
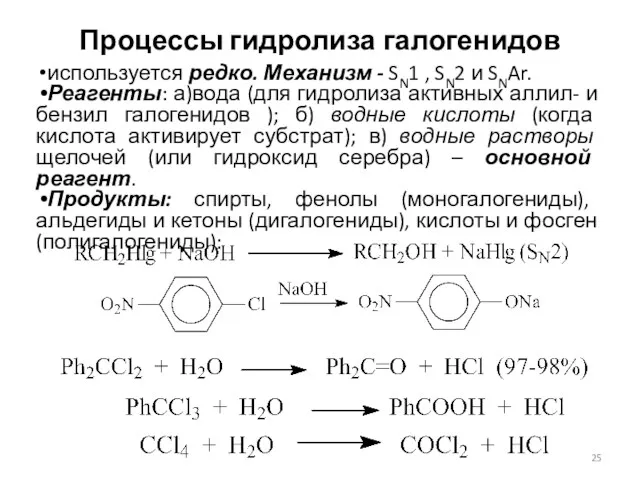
- 25. Процессы гидролиза галогенидов используется редко. Механизм - SN1 , SN2 и SNAr. Реагенты: а)вода (для гидролиза
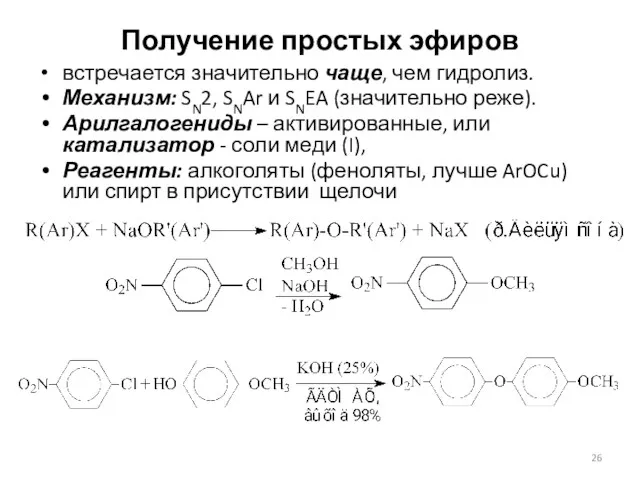
- 26. Получение простых эфиров встречается значительно чаще, чем гидролиз. Механизм: SN2, SNAr и SNEA (значительно реже). Арилгалогениды
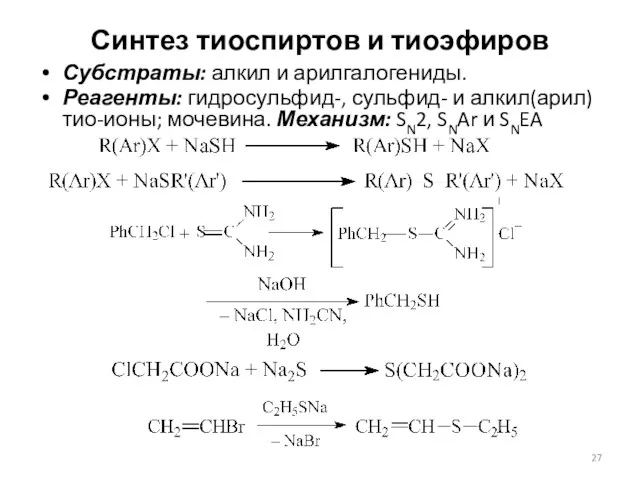
- 27. Синтез тиоспиртов и тиоэфиров Субстраты: алкил и арилгалогениды. Реагенты: гидросульфид-, сульфид- и алкил(арил)тио-ионы; мочевина. Механизм: SN2,
- 28. Замена атома галогена на аминогруппы Особенности реакций неактивированных галогенаренов с аммиаком и аминами (механизм, условия реакции,
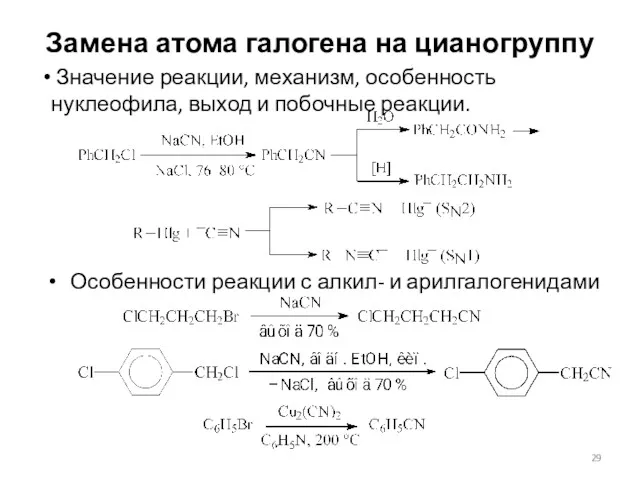
- 29. Замена атома галогена на цианогруппу Особенности реакции с алкил- и арилгалогенидами Значение реакции, механизм, особенность нуклеофила,
- 31. Скачать презентацию













 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей