Слайд 2
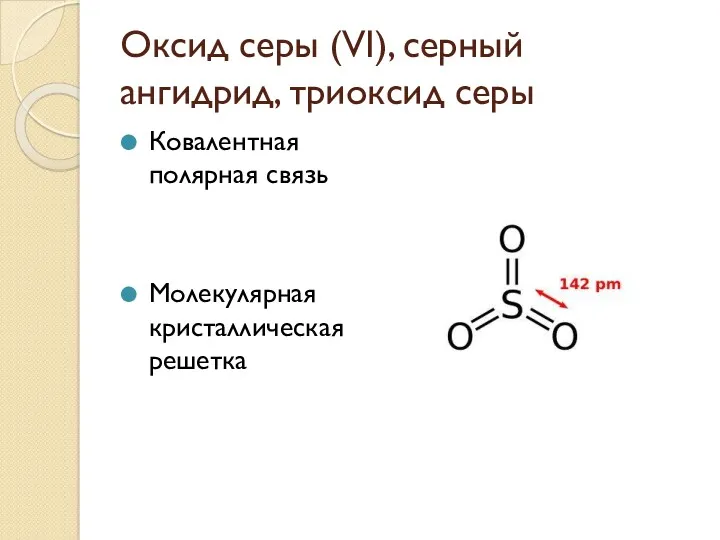
Оксид серы (VI), серный ангидрид, триоксид серы
Ковалентная полярная связь
Молекулярная кристаллическая решетка
Слайд 3

Физические свойства серного ангидрида
Бесцветная, летучая, маслянистая жидкость, t° пл. = 17°C; t°
кип. = 45°С; на воздухе "дымит", сильно поглощает влагу (хранят в запаянных сосудах
Слайд 4

Химические свойства
I. SO3 - представитель кислотных оксидов
1)
2)
3)
Слайд 5

Получение оксида серы (VI)
1. Окисление оксида серы (IV)
Слайд 6

H2SO4 серная кислота
Дать классификацию серной кислоте.
Слайд 7
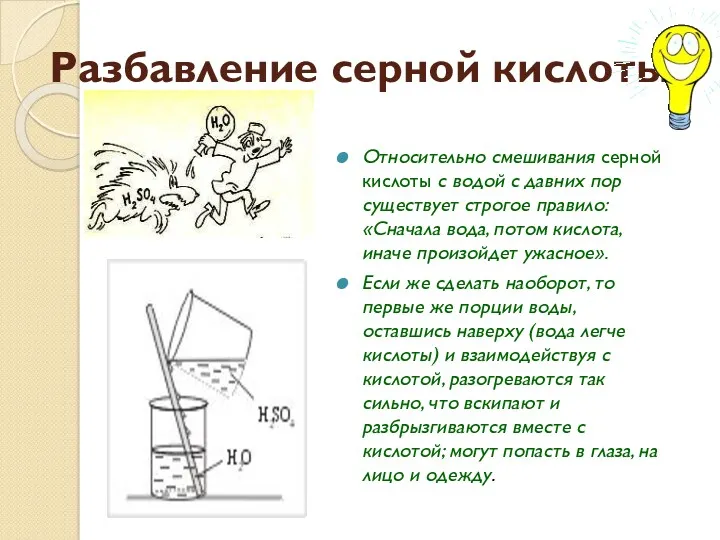
Разбавление серной кислоты
Относительно смешивания серной кислоты с водой с давних пор
существует строгое правило: «Сначала вода, потом кислота, иначе произойдет ужасное».
Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду.
Слайд 8

Химические свойства серной кислоты
разбавленная серная кислота проявляет все характерные свойства кислот:
С
оксидами металлов.(реакция обмена)
Н2SO4+MeO→MeSO4+H2O
2. С основаниями.(реакция обмена, реакция нейтрализации)
Н2SO4+Me(OН)n→MeSO4+H2O
3. С металлами.
Н2SO4+Me(до Н)→MeSO4(р)+H2↑(реакция замещения)
4.С солями( реакция обмена)
Н2SO4+MeR(Р)→MeSO4 (Р)+HR
(протекает в том случае, если образуется осадок или газ)
Слайд 9

Качественная реакция на ион –SO42-
Реактивом на серную кислоту и ее соли
является катион бария , т.к. с ионами бария сульфат ион образует белый нерастворимый сульфат бария, выпадающий в осадок.
Ва2++SO42- = BaSO4↓
Слайд 10

Концентрированная серная кислота
Ме+Н2SO4(кoнц)→МеSO4+H2O+(Н2S,S,SO2)
Серная кислота(конц) восстанавливается до
(Н2S,S,SO2) в зависимости от активности
металла и условий протекания реакции.
Железо и алюминий пассивируются кислотой, т.е покрываются защитной пленкой, поэтому кислоту(конц) можно перевозить в стальных и алюминиевых цистернах.
Сu+2H2SO4(конц)→CuSO4+2H2O+SO2
4Zn+5H2SO4(конц)→4ZnSO4+4H2O+H2S
Концентрированная серная кислота способна отнимать воду из молекул органических веществ, обугливая их.
Взаимодействие кислоты с сахарозой(C12H22O11)
C12H22O11 + 2H2SO4(конц) = 11C + 13H2O↑ +2SO2↑ +CO2↑
Слайд 11
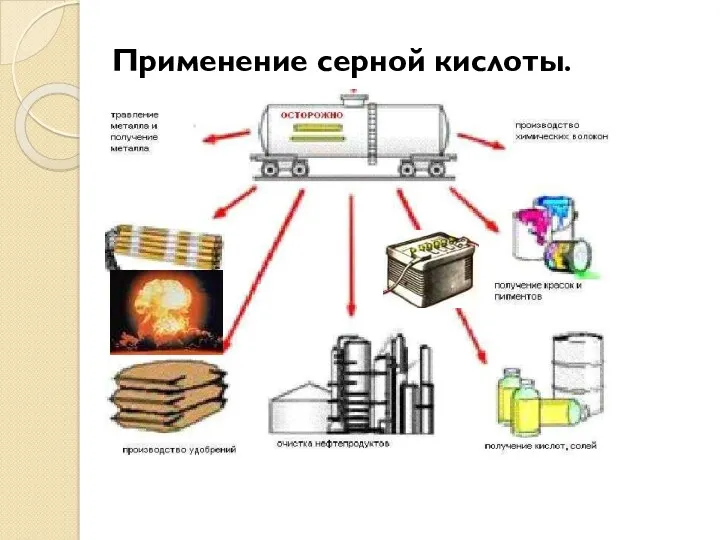
Применение серной кислоты.










 Непредельные углеводороды: алкены, олефины
Непредельные углеводороды: алкены, олефины Основы коррозии и защиты металлов. Виды коррозии металлов
Основы коррозии и защиты металлов. Виды коррозии металлов Реакционная способность твердых тел и способы ее регулирования
Реакционная способность твердых тел и способы ее регулирования Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Водород
Водород Химические профессии на стройках Олимпиады
Химические профессии на стройках Олимпиады Основные классы неорганических веществ
Основные классы неорганических веществ Химическое равновесие. Азот (продолжение). 9 класс
Химическое равновесие. Азот (продолжение). 9 класс Физические и химические свойства алкенов
Физические и химические свойства алкенов Распространение водорода в природе. Получение в лаболатории
Распространение водорода в природе. Получение в лаболатории Природные источники углеводородов
Природные источники углеводородов Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Стронций
Стронций Пластмасса, пластикалық материалдар
Пластмасса, пластикалық материалдар Генетическая связь органических и неорганических соединений
Генетическая связь органических и неорганических соединений Строение атома. Химия. 11 класс
Строение атома. Химия. 11 класс Нефть и ее роль в мировой экономике
Нефть и ее роль в мировой экономике Электролиз: опыты к заданиям ЕГЭ
Электролиз: опыты к заданиям ЕГЭ Тепловой эффект химических реакций
Тепловой эффект химических реакций Алкадиены
Алкадиены Теория электролитической диссоциации
Теория электролитической диссоциации Производные 8-замещенных хинолина
Производные 8-замещенных хинолина Сопряжение электронной плотности, как фактор обеспечения стабильности молекул
Сопряжение электронной плотности, как фактор обеспечения стабильности молекул Реакции ионного обмена
Реакции ионного обмена Технология производства бутилкаучука
Технология производства бутилкаучука Алкины — углеводороды, содержащие тройную связь между атомами углерода
Алкины — углеводороды, содержащие тройную связь между атомами углерода Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds Пниктогены - элеметны VA группы
Пниктогены - элеметны VA группы