Содержание
- 2. Азот Оксиды азота: Степени окисления N в оксидах: +1, +2, +3, +4, +5. N2O, NO -
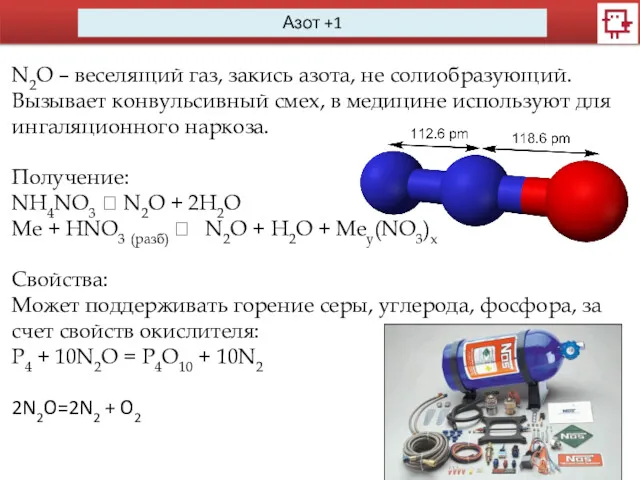
- 3. Азот +1 N2O – веселящий газ, закись азота, не солиобразующий. Вызывает конвульсивный смех, в медицине используют
- 4. Азот +2 NO – несолеобразующий оксид азота, химические активен. Получение: N2 + O2 ? N2O +
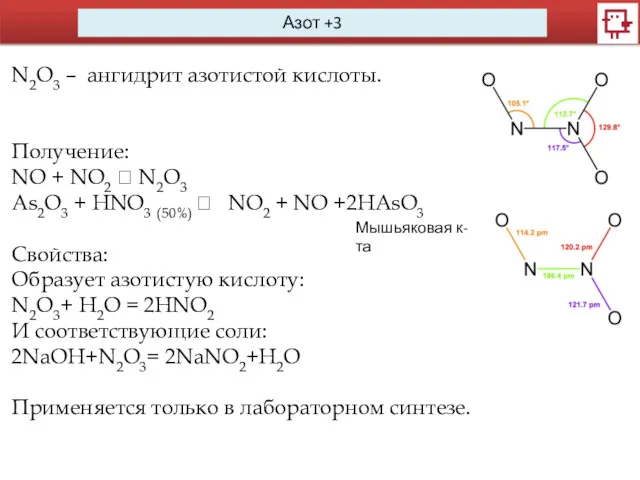
- 5. Азот +3 N2O3 – ангидрит азотистой кислоты. Получение: NО + NO2 ? N2O3 As2O3 + HNO3
- 6. Азот +4 NO2 – бурый газ. Часто образует димеры: N2O4. Получение: Me + HNO3 (>50%) ?
- 7. Азот +5 HNO3 – азотная кислота, в чистом виде – жидкость с удушливым запахом. Может образовываться
- 8. Азот +5 HNO3 – азотная кислота, в чистом виде – жидкость с удушливым запахом. Может образовываться
- 9. Азот +5 Растворение золота в царской водке: Au + HNO3 + 3HCl ? AuCl3 + NO
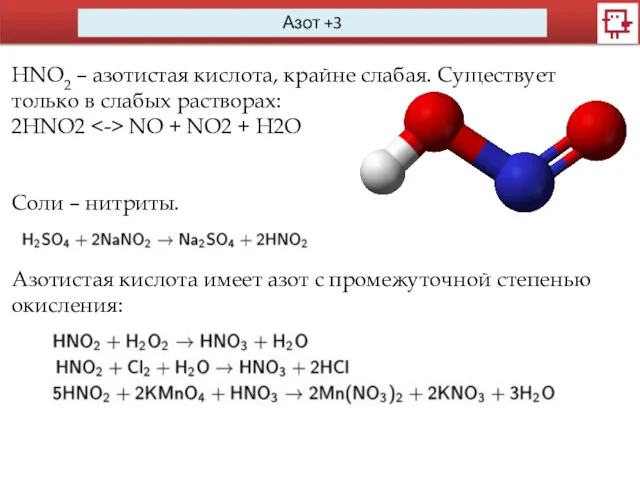
- 10. Азот +3 HNO2 – азотистая кислота, крайне слабая. Существует только в слабых растворах: 2HNO2 NO +
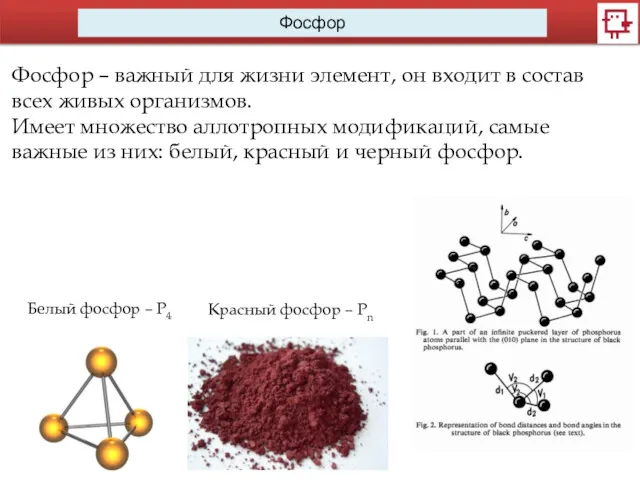
- 11. Фосфор Фосфор – важный для жизни элемент, он входит в состав всех живых организмов. Имеет множество
- 12. Белый фосфор Для белого фосфора характерна повышенная химическая активность, при комнатной температуре: Р4 + 5О2 ?
- 13. Фосфор Фосфор реагирует с металлами, образуя фосфиды: 6Mg + P4 ? 2Mg3P2 Mg3P2 + 6H2O ?
- 14. Фосфор Водородное соединение фосфора – фосфин PH3. Оно менее устойчивое, нежели аммиак и является чрезвычайно ядовитым
- 15. Фосфор Галогениды фосфора. Они широко используются в органической химии, как хлорирующие реагенты. PCl3 + 3H2O ?
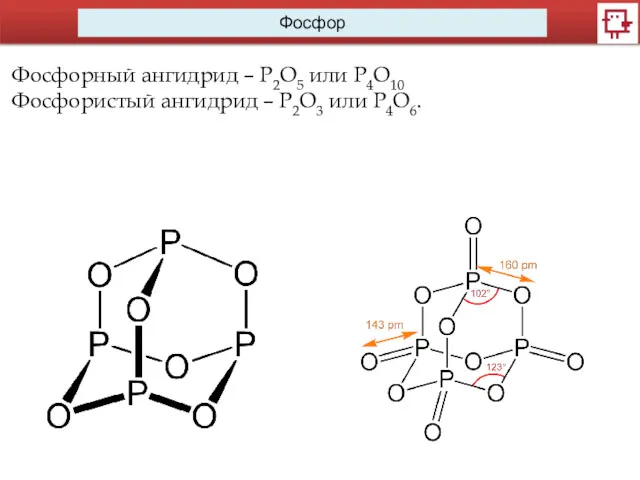
- 16. Фосфор Фосфорный ангидрид – P2O5 или P4O10 Фосфористый ангидрид – P2O3 или P4O6.
- 18. Скачать презентацию










 Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи
Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи Шкідливі хімічні речовини, забруднювачі атмосфери
Шкідливі хімічні речовини, забруднювачі атмосфери Растворы ВМС
Растворы ВМС Геохимия изотопов стабильных элементов
Геохимия изотопов стабильных элементов Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Галогены. Нахождение в природе
Галогены. Нахождение в природе Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory Спирттер мен фенолдар
Спирттер мен фенолдар Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Составление уравнений ОВР
Составление уравнений ОВР Введение в химию. 8 класс
Введение в химию. 8 класс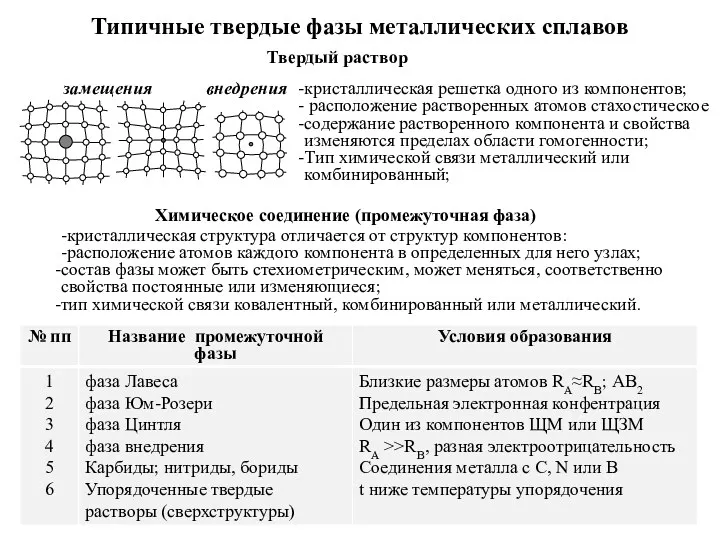 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Химия в повседневной жизни человека
Химия в повседневной жизни человека Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета
Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета Полимеры. Мономер
Полимеры. Мономер Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Решение упражнений по теме: Углеводы
Решение упражнений по теме: Углеводы Электрохимические методы
Электрохимические методы Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами
Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами Роль хімічних знань у пізнанні природи
Роль хімічних знань у пізнанні природи Жиры и масла
Жиры и масла Введение в химию. Что изучает химия?
Введение в химию. Что изучает химия? Кислород и озон
Кислород и озон Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості
Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп