Содержание
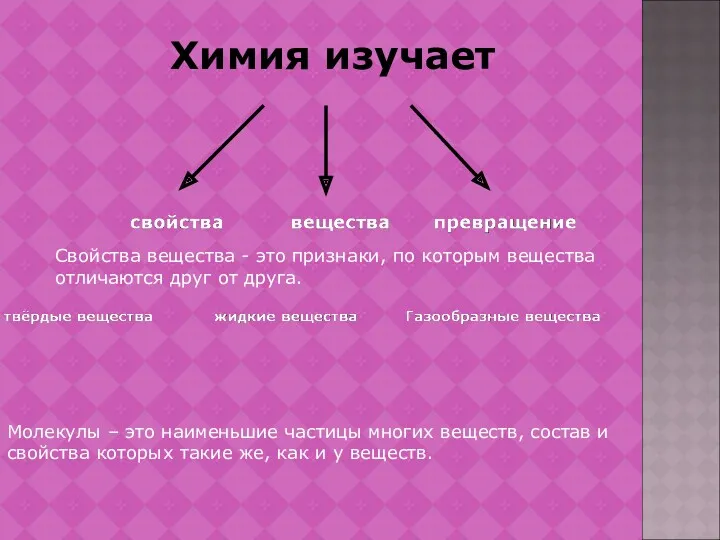
- 2. Химия изучает Свойства вещества - это признаки, по которым вещества отличаются друг от друга. Молекулы –
- 3. Атомы – это мельчайшие химически неделимые частицы вещества. Химический элемент – это определённый вид атомов. Простые
- 4. Символы химических элементов введены в 1814 году шведским химиком Й. Я. Берцелиусом.
- 5. Лабораторная посуда Колба Химический стакан Мерный цилиндр Воронка Большие и маленькие колбы
- 6. ИЗУЧЕНИЕ СТРОЕНИЯ ПЛАМЕНИ СПИРТОВКИ 1.Фитиль 2.Диск с трубкой 3.Резервуар (сосуд) 4.Колпачок
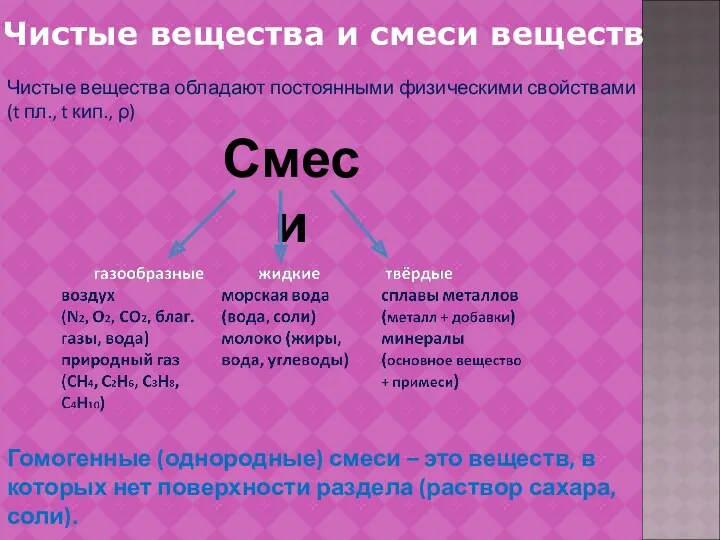
- 7. Чистые вещества и смеси веществ Чистые вещества обладают постоянными физическими свойствами (t пл., t кип., ρ)
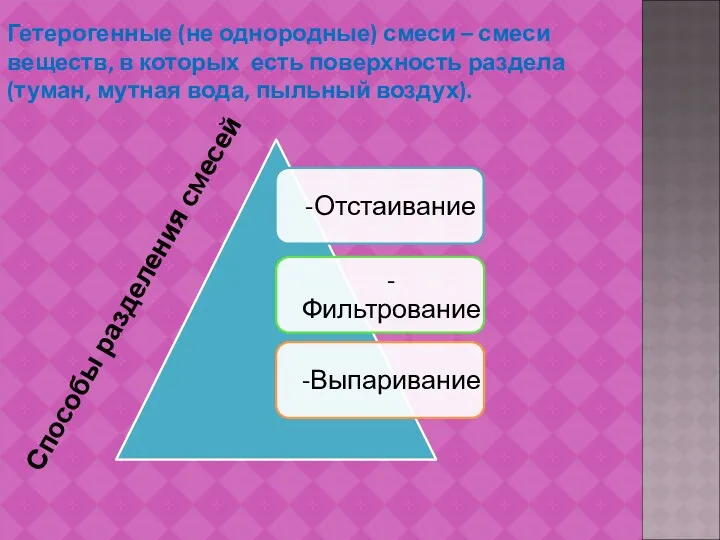
- 8. Гетерогенные (не однородные) смеси – смеси веществ, в которых есть поверхность раздела (туман, мутная вода, пыльный
- 9. Отстаивание – способ разделения смеси, который основан на различной плотности веществ. Фильтрование – способ разделения смеси,
- 10. Концентрация растворов m р – ра = m р.в. + m р - ля 100% =
- 11. АТОМ Атом – это электронейтральная и химически неделимая частица, состоящая из положительно заряженного ядра и движущихся
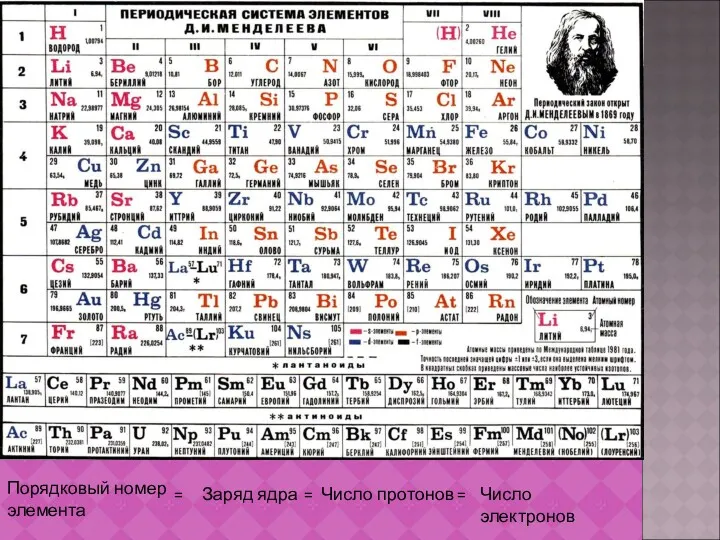
- 12. Порядковый номер элемента = Заряд ядра = Число протонов = Число электронов
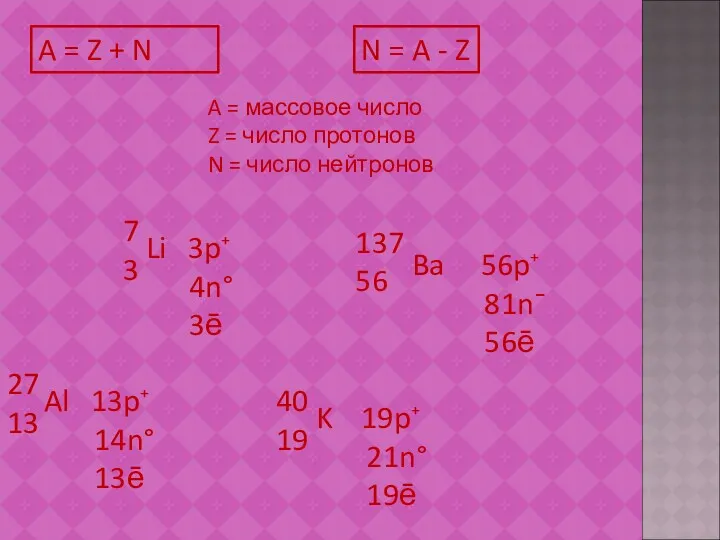
- 13. A = Z + N A = массовое число Z = число протонов N = число
- 14. Строение электронной оболочки Строение электронной оболочки – это совокупность всех электронов в атоме. Электронный слой или
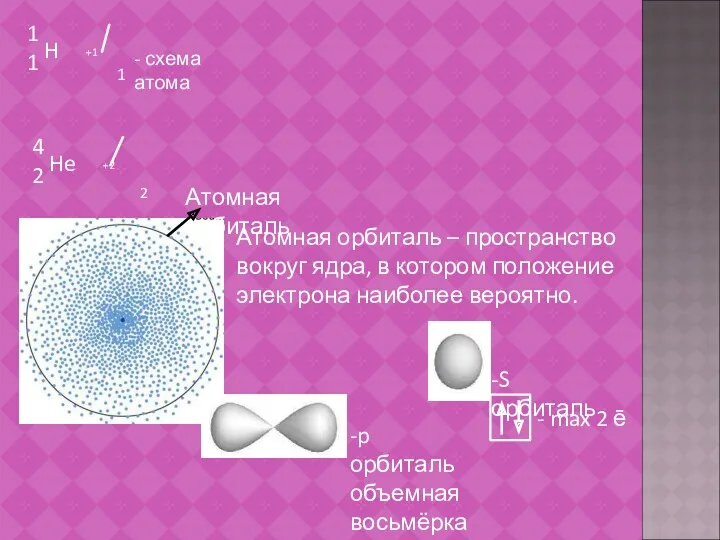
- 15. Атомная орбиталь – пространство вокруг ядра, в котором положение электрона наиболее вероятно.
- 16. d и f орбитали более сложные по форме и энергии. Схема строения атома
- 18. Скачать презентацию









 Металлы, их свойства и область применения
Металлы, их свойства и область применения Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Тяжелые металлы
Тяжелые металлы Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Значение пищи и ее состав
Значение пищи и ее состав Коррозия металлов
Коррозия металлов Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Борьба с биологической коррозией
Борьба с биологической коррозией Реакции ионного обмена
Реакции ионного обмена Спирты
Спирты Газовые смеси
Газовые смеси Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Адсорбция
Адсорбция Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химические реакции или химические явления
Химические реакции или химические явления Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Хром, марганец
Хром, марганец Химическая кинетика и катализ
Химическая кинетика и катализ Свойства фосфора
Свойства фосфора Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Тұндыру әдістері
Тұндыру әдістері Термодинамика химических процессов
Термодинамика химических процессов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН