Содержание
- 2. Простые правила
- 3. Учение о растворах Якоб Хендрик Вант-Гофф 1852-1911 Сванте Август Аррениус 1859-1927 Фридрих Вильгельм Оствальд 1853-1932 Рихард
- 4. Раствор - гомогенная (однородная), устойчивая система переменного состава, состоящая из двух и более компонентов. Компоненты раствора
- 5. Подробнее о способах выражения состава растворов и связи между ними вы познакомитесь на лабораторных занятиях Способы
- 6. Растворение – физико-химический процесс, где происходит взаимодействие между частицами, образующими раствор, и равномерное распределение частиц.
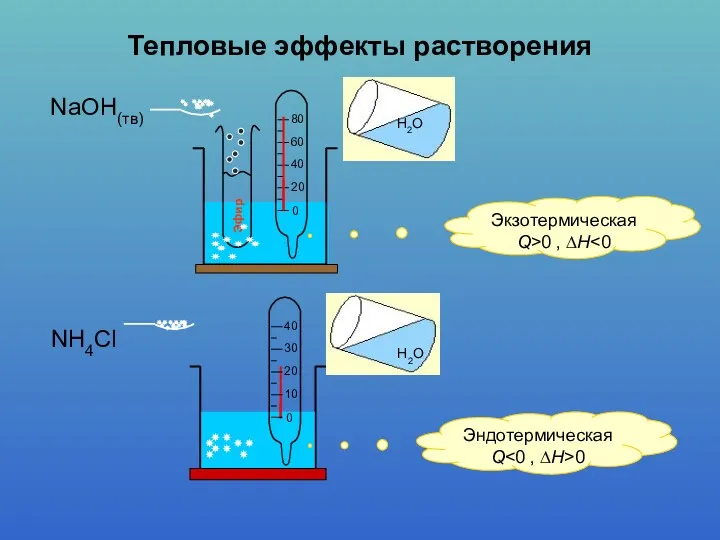
- 7. Экзотермическая Q>0 , ∆H NaOH(тв) Н2О NH4Cl Эндотермическая Q 0 Тепловые эффекты растворения
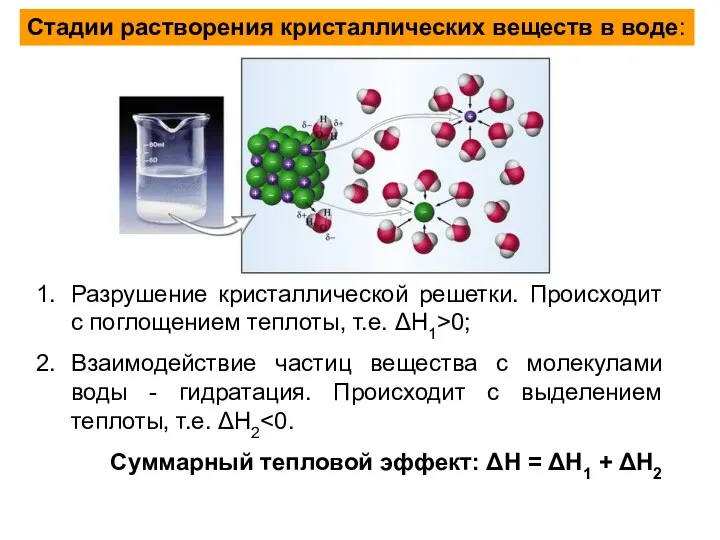
- 8. Стадии растворения кристаллических веществ в воде: Разрушение кристаллической решетки. Происходит с поглощением теплоты, т.е. ΔН1>0; Взаимодействие
- 9. «Подобное растворяется в подобном» Вещества с ионным типом хим. связи лучше растворяются в полярных растворителях, неполярные
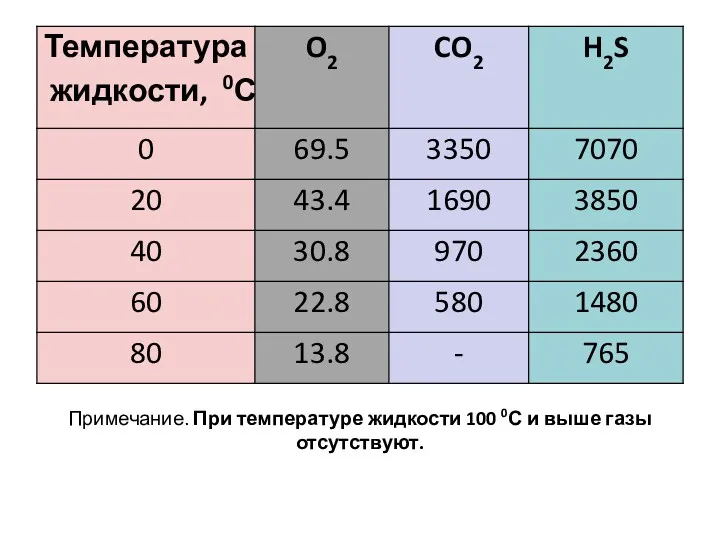
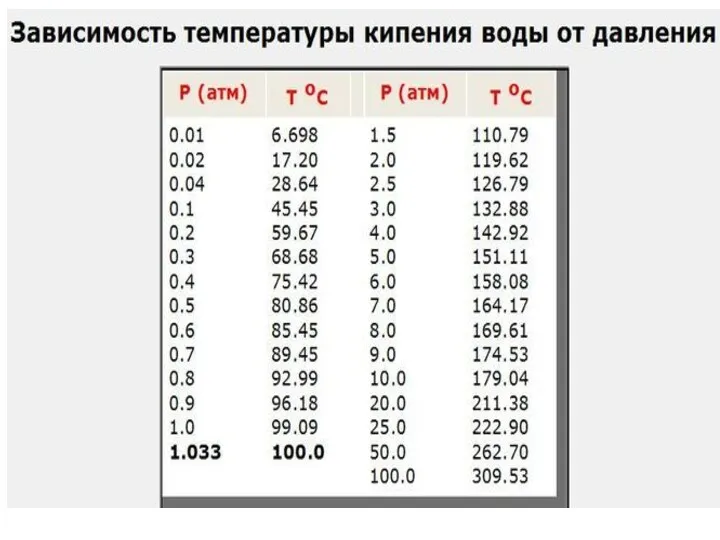
- 10. Примечание. При температуре жидкости 100 0С и выше газы отсутствуют.
- 11. Растворимость газов увеличивается при повышении давления. 3. Давление (для газов)
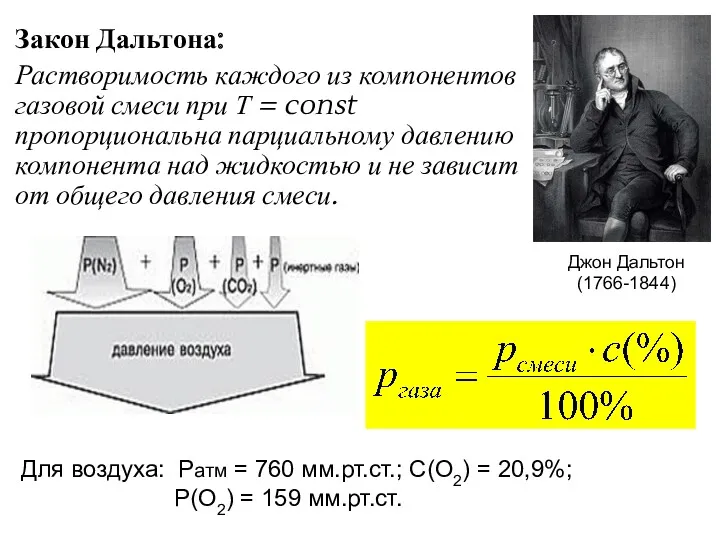
- 12. Закон Дальтона: Растворимость каждого из компонентов газовой смеси при Т = const пропорциональна парциальному давлению компонента
- 13. S = k ∙ р0 Закон Генри: Растворимость (концентрация) газа в жидкости при Т=const пропорциональна парциальному
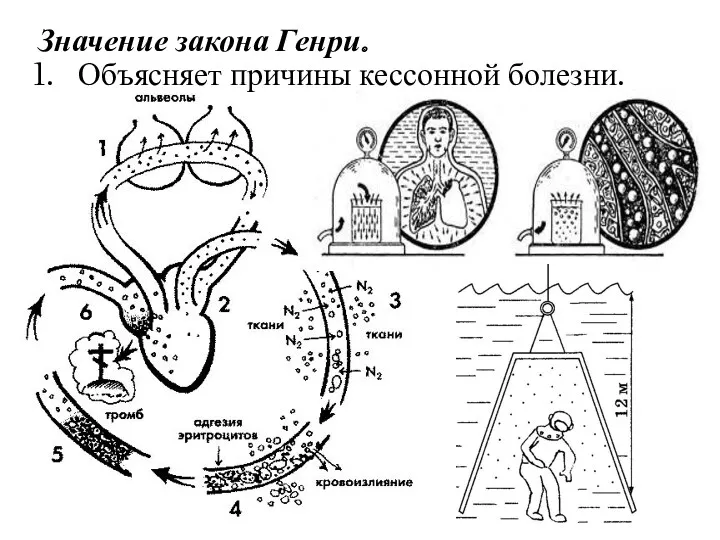
- 14. Значение закона Генри. Объясняет причины кессонной болезни.
- 15. 2. Объясняет причины горной гипоксии. 3. Обосновывает применение барокамер. Системы общей и местной кислородной терапии открытых
- 16. где S и S0 – растворимость газа в растворе электролита и в чистом растворителе, k –
- 17. Электролитами называются вещества, расплавы и растворы которых содержат подвижные ионы и проводят эл. ток. Явление распада
- 18. Степень диссоциации (α) - отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул
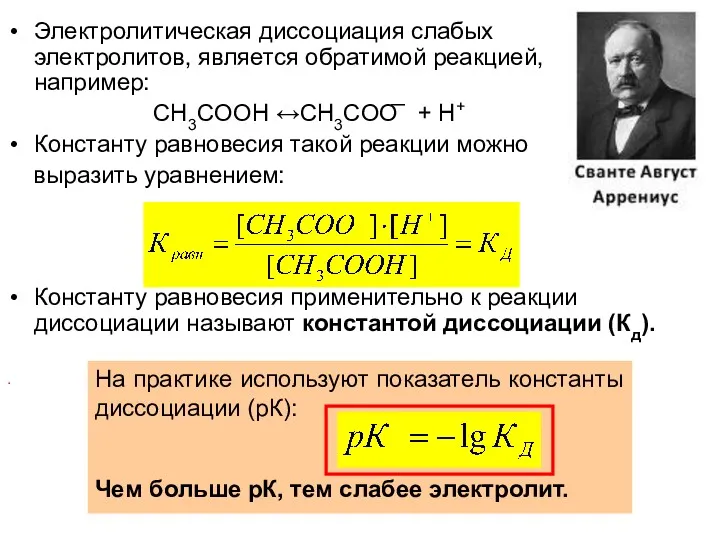
- 20. Электролитическая диссоциация слабых электролитов, является обратимой реакцией, например: CH3COOH ↔CH3COO͞ + H+ Константу равновесия такой реакции
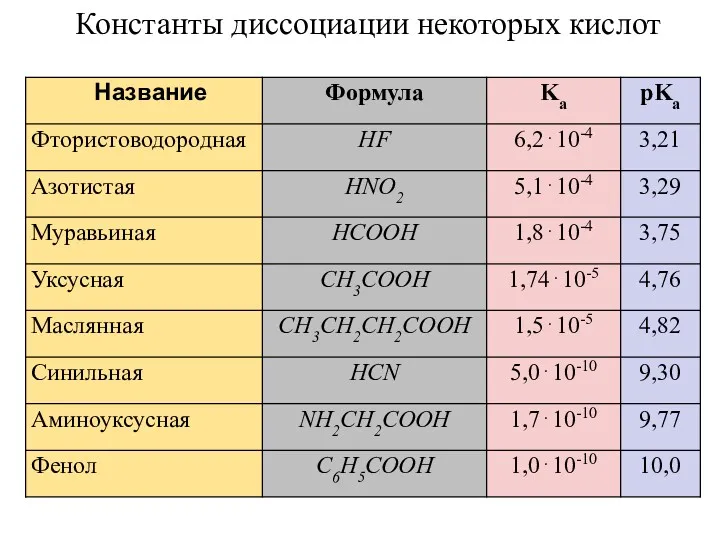
- 21. Константы диссоциации некоторых кислот
- 22. Факторы, влияющие на α и Кд: природа электролита и растворителя: чем полярнее хим. связь в молекуле
- 23. Связь константы диссоциации и степени диссоциации (закон разведения Оствальда) для слабых электролитов α → 0 и
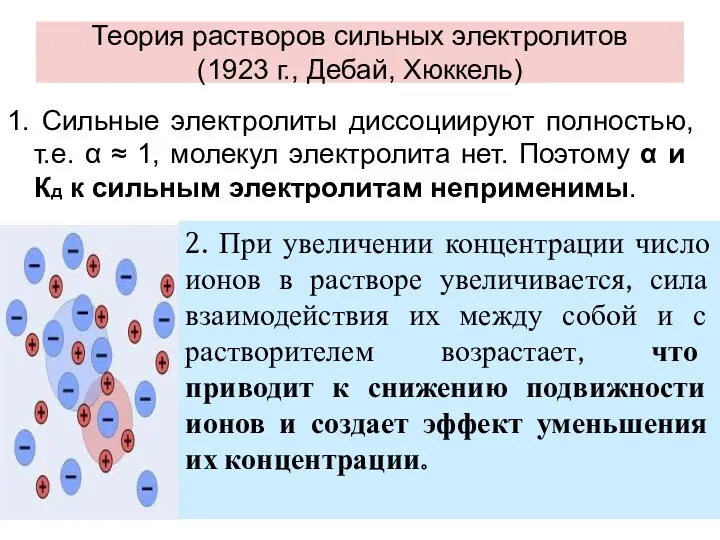
- 24. Теория растворов сильных электролитов (1923 г., Дебай, Хюккель) 1. Сильные электролиты диссоциируют полностью, т.е. α ≈
- 25. В разбавленных растворах γ = 1, тогда а = С. Коэффициент активности иона (γ) зависит: температуры;
- 26. Ионная сила раствора (I) - величина, характеризующая силу электростатического взаимодействия ионов в растворе, которая равна полусумме
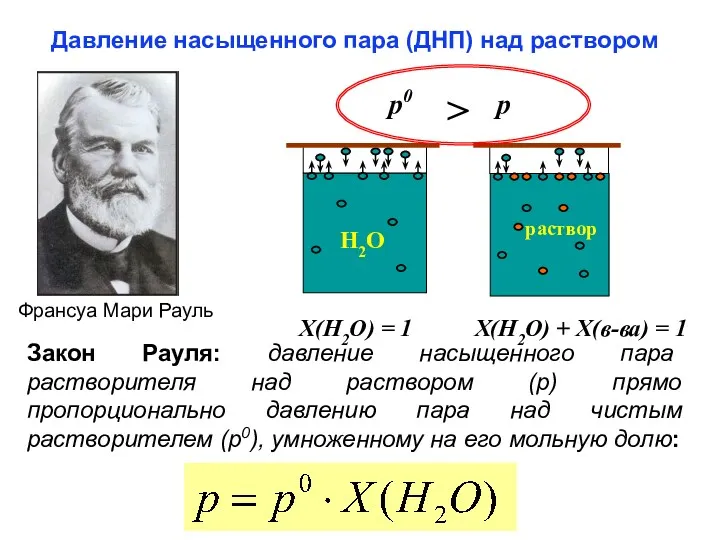
- 28. Давление насыщенного пара (ДНП) над раствором Франсуа Мари Рауль p0 > p Х(Н2О) = 1 Х(Н2О)
- 29. Вторая формулировка закона Рауля: относительное понижение давления насыщенного пара растворителя (p0) над раствором (p) пропорционально мольной
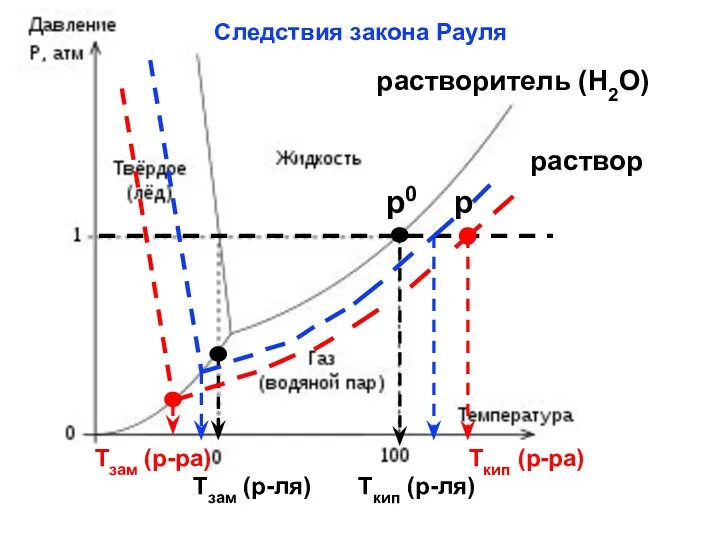
- 30. КС – линия испарения (ж → п) КВ – линия кристаллизации (ж → тв) КА –
- 31. Tкип (р-ра) Tзам (р-ра) р раствор растворитель (Н2О) Следствия закона Рауля
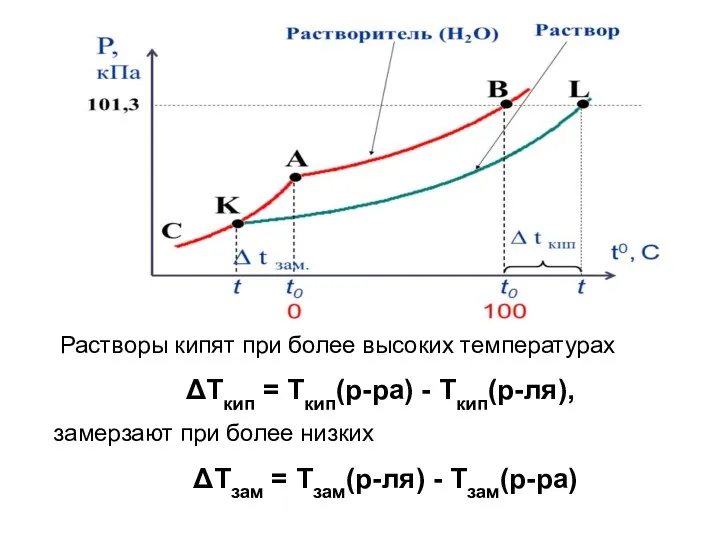
- 32. Растворы кипят при более высоких температурах ΔТкип = Ткип(р-ра) - Ткип(р-ля), замерзают при более низких ΔТзам
- 33. Понижение Тзам и повышение Ткип растворов пропорционально моляльности раствора: ΔТзам = Ккр • Сm, Ккр –
- 34. эти константы зависят от природы растворителя при Сm = 1 моль/кг; Ккр = ΔТзам; Кэб =
- 35. В растворах электролитов число частиц больше из-за диссоциации. Вант-Гофф ввел поправочный изотонический коэффициент (i), который учитывает
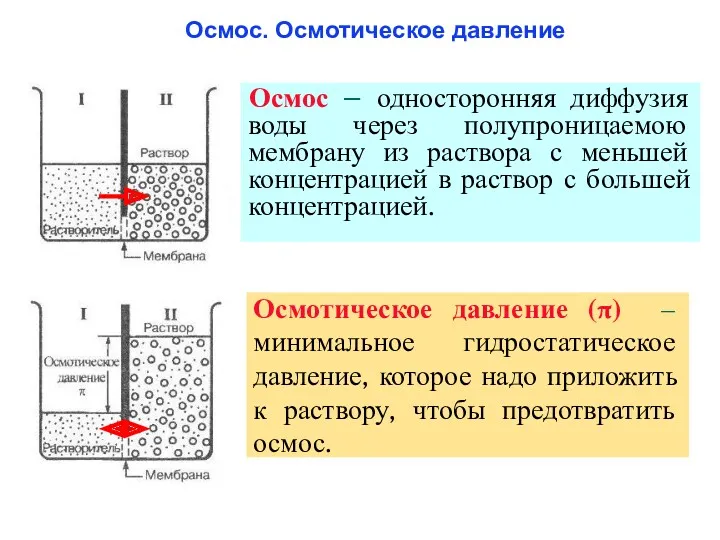
- 36. Осмос. Осмотическое давление Осмос – односторонняя диффузия воды через полупроницаемою мембрану из раствора с меньшей концентрацией
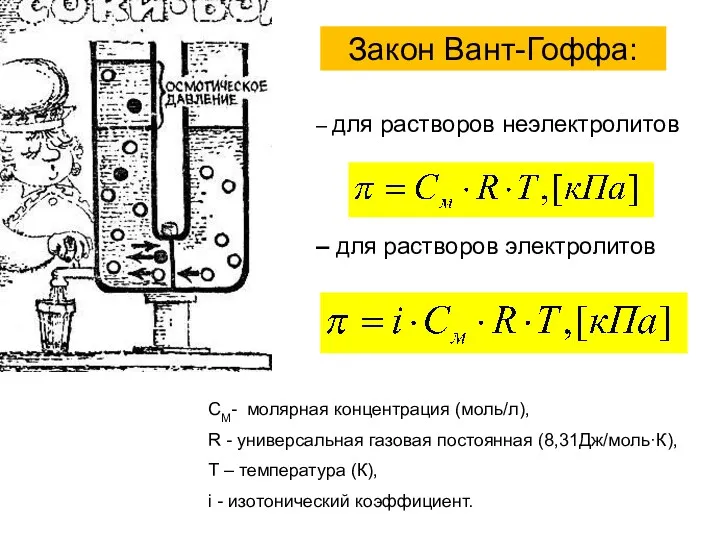
- 37. Закон Вант-Гоффа: – для растворов неэлектролитов – для растворов электролитов СМ- молярная концентрация (моль/л), R -
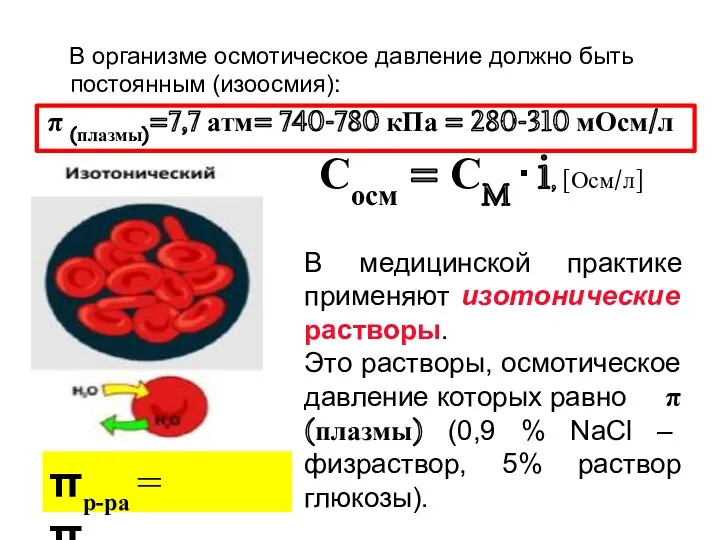
- 38. В организме осмотическое давление должно быть постоянным (изоосмия): π (плазмы)=7,7 атм= 740-780 кПа = 280-310 мОсм/л
- 39. Растворы, у которых π больше, чем у π (плазмы) , называются гипертоническими. В медицине они применяются
- 40. Растворы, у которых π меньше, чем у π (плазмы) , называются гипотоническими. В медицине они для
- 41. Значение осмоса ⮚ упругость, тургор клеток ⮚ эластичность тканей, форма органов ⮚ усвоение пищи, образование лимфы,
- 42. Методы, основанные на изучении коллигативных свойств растворов осмометрия – измерение π, криоскопия – измерение ΔТзам (р-ра),
- 43. Применяются для определения : молекулярных масс различных веществ, чаще всего биополимеров (белков); суммарной концентрации всех растворенных
- 45. Скачать презентацию



























 Аллотропия
Аллотропия Основные классы неорганических соединений
Основные классы неорганических соединений Нуклеиновые кислоты. Нуклеотиды
Нуклеиновые кислоты. Нуклеотиды Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Основные синтетические полимеры
Основные синтетические полимеры Кислотные дожди
Кислотные дожди Механизмы трансформации энергии в фотосинтезе
Механизмы трансформации энергии в фотосинтезе 20230330_zakony_termodinamiki_i_kinetika
20230330_zakony_termodinamiki_i_kinetika S-элементтердің жалпы сипаттамасы
S-элементтердің жалпы сипаттамасы 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft Общая характеристика элементов главной подгруппы второй группы
Общая характеристика элементов главной подгруппы второй группы Розв’язування задач на приготування розчинів із кристалогідратів
Розв’язування задач на приготування розчинів із кристалогідратів Термодинамика растворов неэлектролитов
Термодинамика растворов неэлектролитов Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Технология монокристаллов и особо чистых веществ
Технология монокристаллов и особо чистых веществ Оксиды и гидроксиды металлов. 11 класс
Оксиды и гидроксиды металлов. 11 класс Химические реакции или химические явления
Химические реакции или химические явления Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Факторы и процессы формирования химического состава подземных вод
Факторы и процессы формирования химического состава подземных вод Комплексиметрическое титрование
Комплексиметрическое титрование Электролиз. Классификация
Электролиз. Классификация Фенол. Феноловая катастрофа
Фенол. Феноловая катастрофа Составление формул молекулярных простых веществ
Составление формул молекулярных простых веществ Щавелевая кислота
Щавелевая кислота Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Кислоты. Определение и классификация
Кислоты. Определение и классификация Исследование Е. Е. Вагнера в области терпенов и камфоры
Исследование Е. Е. Вагнера в области терпенов и камфоры