Содержание
- 3. Ядродан қашықтаған сайын ядромен валенттік электрондардың байланысы әлсірейді, сондықтан бұл металдардың химиялық белсенділігі топтарда артады. s–элементтердің
- 4. Сілтілік металдар IА тобының металдары сілтілік металдар деп аталады. Олар сумен белсенді әрекеттескенде сілті түзетіндіктен осылайша
- 5. Физикалық қасиеттері. Сілтілік металдардың физикалық қасиеттері көбінесе кристалдық тор құрылысының ерекшелігіне тәуелді. Сілтілік металдардың қасиеттері Барлық
- 6. Сілтілік металдар тікелей барлық бейметалдармен, сонымен бірге сумен, қышқылдармен әрекеттеседі. Табиғатта тек қана байланысқан түрде (хлоридтер,
- 8. Сілтілікжер металдардың сипаттамалары II топтың негізгі топша элементтерінің атомдарынан түзілген металдардың қасиеттері IIА топ элементтерінің периодтық
- 10. Скачать презентацию
Слайд 2
Слайд 3
Ядродан қашықтаған сайын ядромен валенттік электрондардың байланысы әлсірейді, сондықтан бұл
Ядродан қашықтаған сайын ядромен валенттік электрондардың байланысы әлсірейді, сондықтан бұл
металдардың химиялық белсенділігі топтарда артады. s–элементтердің сипаттамаларын салыстыру көрсеткендей, цезий (Сs) атомынан сыртқы электрон жеңіл үзіледі, сондықтан Сs – ең белсенді металл және өте күшті тотықсыздандырғыш (франций радиоактивті және аз зерттегендіктен қарастырылмайды).
Жай заттардың – металдардың қасиеттері атомдардағы сыртқы электрондардың санына байланысты болады. Металл кристалындағы байланыстың беріктігі айналу процесіне жұмсалған атомдану энергиясымен өлшенеді:
Me (қ.) → Ме (г.)
жай металл
зат атомы
Атомдану энергиясы және оған байланысты металдардың физикалық сипматтамалары сыртқы электрондық қабаттағы электрондардың санының артуымен өседі.
Атомдану энергиясына байланысты металдардың қайнау температураларының өзгеруі
Жай заттардың – металдардың қасиеттері атомдардағы сыртқы электрондардың санына байланысты болады. Металл кристалындағы байланыстың беріктігі айналу процесіне жұмсалған атомдану энергиясымен өлшенеді:
Me (қ.) → Ме (г.)
жай металл
зат атомы
Атомдану энергиясы және оған байланысты металдардың физикалық сипматтамалары сыртқы электрондық қабаттағы электрондардың санының артуымен өседі.
Атомдану энергиясына байланысты металдардың қайнау температураларының өзгеруі
Слайд 4
Сілтілік металдар
IА тобының металдары сілтілік металдар деп аталады. Олар
Сілтілік металдар
IА тобының металдары сілтілік металдар деп аталады. Олар
сумен белсенді әрекеттескенде сілті түзетіндіктен осылайша аталған.
Натрий және калий (элементтердің таралуы бойынша Na алтыншы, К – жетінші орында ) табиғатта кең таралған; литий, рубидий, цезий – сирек элементтер, франций – жер қыртысында болмайтын радиоактивті элемент
Сілтілік металдардың сипаттамалары
Ядродан қашықтау валенттік электронның ядромен байланысының әлсіреуіне әкеледі, сондықтан металдардың химиялық белсенділігі топта жоғарыдан төмен қарай өседі.
Натрий және калий (элементтердің таралуы бойынша Na алтыншы, К – жетінші орында ) табиғатта кең таралған; литий, рубидий, цезий – сирек элементтер, франций – жер қыртысында болмайтын радиоактивті элемент
Сілтілік металдардың сипаттамалары
Ядродан қашықтау валенттік электронның ядромен байланысының әлсіреуіне әкеледі, сондықтан металдардың химиялық белсенділігі топта жоғарыдан төмен қарай өседі.
IА топтың периодтық жүйедегі орны
Период
2
3
4
5
6
7
Қасиеттері
Электр –терістілік
0,97
0,93
0,91
0,89
0,86
= 0.86
Слайд 5
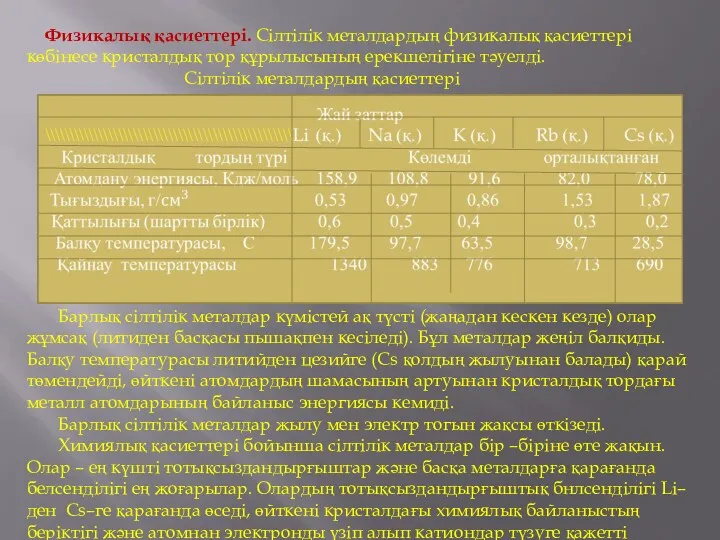
Физикалық қасиеттері. Сілтілік металдардың физикалық қасиеттері көбінесе кристалдық тор құрылысының
Физикалық қасиеттері. Сілтілік металдардың физикалық қасиеттері көбінесе кристалдық тор құрылысының
ерекшелігіне тәуелді.
Сілтілік металдардың қасиеттері
Барлық сілтілік металдар күмістей ақ түсті (жаңадан кескен кезде) олар жұмсақ (литиден басқасы пышақпен кесіледі). Бұл металдар жеңіл балқиды. Балқу температурасы литийден цезийге (Cs қолдың жылуынан балады) қарай төмендейді, өйткені атомдардың шамасының артуынан кристалдық тордағы металл атомдарының байланыс энергиясы кемиді.
Барлық сілтілік металдар жылу мен электр тогын жақсы өткізеді.
Химиялық қасиеттері бойынша сілтілік металдар бір –біріне өте жақын. Олар – ең күшті тотықсыздандырғыштар және басқа металдарға қарағанда белсенділігі ең жоғарылар. Олардың тотықсыздандырғыштық бнлсенділігі Li–ден Cs–ге қарағанда өседі, өйткені кристалдағы химиялық байланыстың беріктігі және атомнан электронды үзіп алып катиондар түзуге қажетті энергия кемиді.
Сілтілік металдардың қасиеттері
Барлық сілтілік металдар күмістей ақ түсті (жаңадан кескен кезде) олар жұмсақ (литиден басқасы пышақпен кесіледі). Бұл металдар жеңіл балқиды. Балқу температурасы литийден цезийге (Cs қолдың жылуынан балады) қарай төмендейді, өйткені атомдардың шамасының артуынан кристалдық тордағы металл атомдарының байланыс энергиясы кемиді.
Барлық сілтілік металдар жылу мен электр тогын жақсы өткізеді.
Химиялық қасиеттері бойынша сілтілік металдар бір –біріне өте жақын. Олар – ең күшті тотықсыздандырғыштар және басқа металдарға қарағанда белсенділігі ең жоғарылар. Олардың тотықсыздандырғыштық бнлсенділігі Li–ден Cs–ге қарағанда өседі, өйткені кристалдағы химиялық байланыстың беріктігі және атомнан электронды үзіп алып катиондар түзуге қажетті энергия кемиді.
Слайд 6
Сілтілік металдар тікелей барлық бейметалдармен, сонымен бірге сумен, қышқылдармен әрекеттеседі.
Сілтілік металдар тікелей барлық бейметалдармен, сонымен бірге сумен, қышқылдармен әрекеттеседі.
Табиғатта тек қана байланысқан түрде (хлоридтер, силикаттар, сульфаттар) кездеседі.
Сілтілік металдардың жоғары реакциялық қабілеттерін ескеріп, оларды керосиннің немесе парафин майының (сұйық қаныққан көмірсутектер) астында сақтайды.
Топтың негізгі топшасының металдары
Бериллий Ве, магний Mg, кальций Ca, стронций Sr, барийBa және радий Ra периодтық жүйенің IIА тобын түзеді. Үш металл сілтілікжер металдар топшасын құрайды. Өқлай аталу себебі, олардың оксидтері алхимия кезеңінде «жер» деп аталған, ал оларды суда еріткенде сілтілер алынған.
Магний, кальций, стронций, барийді таза күйінде ағылшын химигі Г.Дэви 1808 ж., бериллийді металл түрінде 1828 ж. Неміс химигі Ф.Велер, сондай-ақ радиоактивті металл радийді 1910 ж. француз химиктері П. Кюри мен М. Кюри алған.
Бериллий – химия тарихына ғылыми пікірталастың элементі ретінде енгізелген. Д.И. Менделеев оның атомдық массасын түзетіп, периодтық заңының дұрыстығын дәлелдегені сендерге белгілі. Зерттеулер Менделеевтің болжауларының растығын дәлелдеді.
Атомдардың құрылысы және химиялық белсенділігі. Бұл топшаның барлық өкілдері s– элементтері. Жай заттары – типтік металдар. Бериллий топшасы элементтері атомдарының сыртқы деңгейінде екі электроннан бар. Оларды беріп жіберіп, қосылыстарда тұрақты +2 тотығу дәрежесін көрсетеді. Топшаның барлық металдары – күшті тотықсыздандырғыштар, бірақ сілтілік металдарға қарағанда едәуір әлсіздеу.
Сілтілік металдардың жоғары реакциялық қабілеттерін ескеріп, оларды керосиннің немесе парафин майының (сұйық қаныққан көмірсутектер) астында сақтайды.
Топтың негізгі топшасының металдары
Бериллий Ве, магний Mg, кальций Ca, стронций Sr, барийBa және радий Ra периодтық жүйенің IIА тобын түзеді. Үш металл сілтілікжер металдар топшасын құрайды. Өқлай аталу себебі, олардың оксидтері алхимия кезеңінде «жер» деп аталған, ал оларды суда еріткенде сілтілер алынған.
Магний, кальций, стронций, барийді таза күйінде ағылшын химигі Г.Дэви 1808 ж., бериллийді металл түрінде 1828 ж. Неміс химигі Ф.Велер, сондай-ақ радиоактивті металл радийді 1910 ж. француз химиктері П. Кюри мен М. Кюри алған.
Бериллий – химия тарихына ғылыми пікірталастың элементі ретінде енгізелген. Д.И. Менделеев оның атомдық массасын түзетіп, периодтық заңының дұрыстығын дәлелдегені сендерге белгілі. Зерттеулер Менделеевтің болжауларының растығын дәлелдеді.
Атомдардың құрылысы және химиялық белсенділігі. Бұл топшаның барлық өкілдері s– элементтері. Жай заттары – типтік металдар. Бериллий топшасы элементтері атомдарының сыртқы деңгейінде екі электроннан бар. Оларды беріп жіберіп, қосылыстарда тұрақты +2 тотығу дәрежесін көрсетеді. Топшаның барлық металдары – күшті тотықсыздандырғыштар, бірақ сілтілік металдарға қарағанда едәуір әлсіздеу.
Слайд 7
Слайд 8
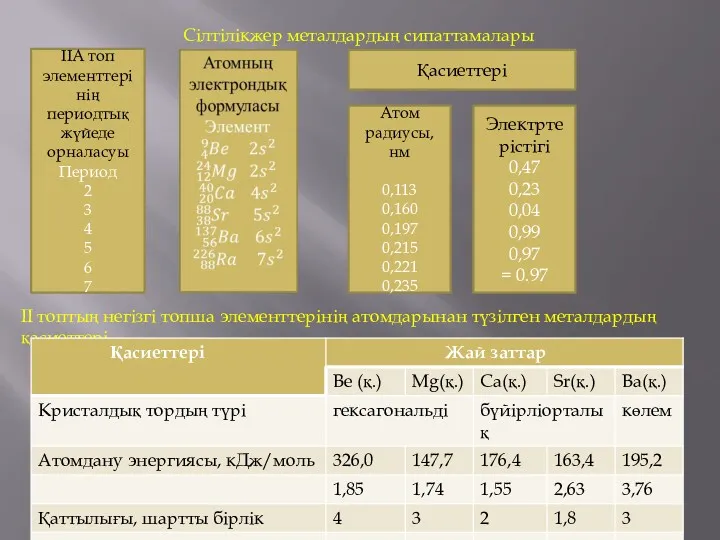
Сілтілікжер металдардың сипаттамалары
II топтың негізгі топша элементтерінің атомдарынан түзілген металдардың
Сілтілікжер металдардың сипаттамалары
II топтың негізгі топша элементтерінің атомдарынан түзілген металдардың
қасиеттері
IIА топ элементтерінің периодтық жүйеде орналасуы
Период
2
3
4
5
6
7
IIА топ элементтерінің периодтық жүйеде орналасуы
Период
2
3
4
5
6
7
Қасиеттері
Атом радиусы, нм
0,113
0,160
0,197
0,215
0,221
0,235
Электртерістігі
0,47
0,23
0,04
0,99
0,97
= 0.97
- Предыдущая
Шкала памяти ВекслераСледующая -
Найди своего героя




 Александр Евгеньевич Ферсман
Александр Евгеньевич Ферсман Кислород и озон
Кислород и озон Алкандар. Метан және оның құрылысы
Алкандар. Метан және оның құрылысы Соли аммония
Соли аммония Химические свойства алканов
Химические свойства алканов Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Углерод. Оксиды углерода
Углерод. Оксиды углерода Применение соляной кислоты и её солей
Применение соляной кислоты и её солей Антибиотики как ЛС
Антибиотики как ЛС Соли. CaSO4 - Сульфат кальция
Соли. CaSO4 - Сульфат кальция Class micro and macro elements
Class micro and macro elements Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Простые вещества – неметаллы
Простые вещества – неметаллы Вычисление массовой доли растворенного вещества. 8 класс
Вычисление массовой доли растворенного вещества. 8 класс Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Ювелирное дело. Империя самоцветов
Ювелирное дело. Империя самоцветов Ферменты в биотехнологии
Ферменты в биотехнологии Строение вещества и агрегатные состояния вещества
Строение вещества и агрегатные состояния вещества Мило та миловаріння
Мило та миловаріння Почему мыло пенится
Почему мыло пенится Основные классы неорганических соединений
Основные классы неорганических соединений Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Химия элементов. Общая характеристика элементов
Химия элементов. Общая характеристика элементов Вклад М.В. Ломоносова в развитие химии
Вклад М.В. Ломоносова в развитие химии Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні