Содержание
- 2. Природные соединения кальция (мел, мрамор, известняк, гипс) и продукты их простейшей переработки (известь) были известны людям
- 3. Физические свойства: Сульфат кальция, известный как пищевая добавка под номером Е516, представляет собой ромбовидные кристаллы, не
- 4. При плавлении разлагается (tпл = 1450˚С). Растворимость CaSO4 повышается в присутствии MgCl2, NaCl, HNO3, HCl. Реагирует
- 5. 1) CaO + H2SO4 = CaSO4 + H2O 2) Ca + H2SO4 = CaSO4 + H2
- 6. Применение: Минерал, состоящий из дигидрата сульфата кальция (гипса) имеет длительную историю своего применения: первые упоминания относительно
- 8. Скачать презентацию





 Химический элемент уран
Химический элемент уран Азот. Элемент V группы главной подгруппы
Азот. Элемент V группы главной подгруппы Алкины. Ацетилен.
Алкины. Ацетилен.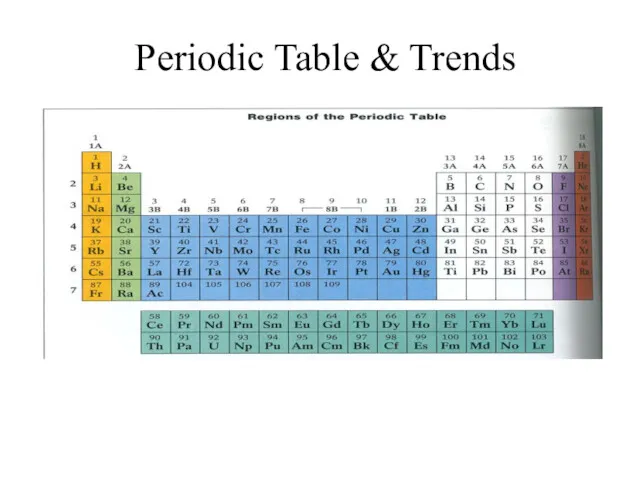 Periodic Table and Trends
Periodic Table and Trends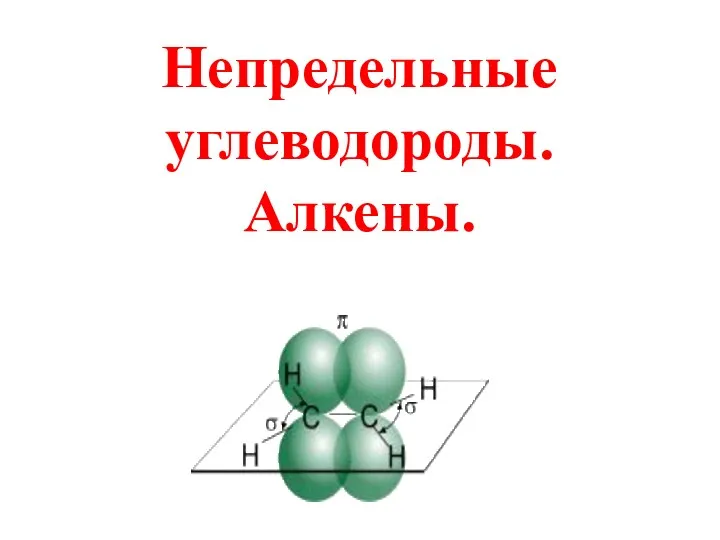 Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Классификация процессов и производств в химической технологии
Классификация процессов и производств в химической технологии Химический элемент. Неон
Химический элемент. Неон Предмет органической химии
Предмет органической химии Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Роль химии в создании новых материалов
Роль химии в создании новых материалов Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Основания
Основания Типы химических реакций
Типы химических реакций Аминокислоты. Номенклатура
Аминокислоты. Номенклатура Производные фурана, пиррола, тиофена
Производные фурана, пиррола, тиофена Функциональные производные углеводородов. Галогенопроизводные углеводородов
Функциональные производные углеводородов. Галогенопроизводные углеводородов Анализ технологии производства с использованием принципов Зеленой химии
Анализ технологии производства с использованием принципов Зеленой химии Минералогия. Формы нахождения минералов в природе. Свойства минералов
Минералогия. Формы нахождения минералов в природе. Свойства минералов Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены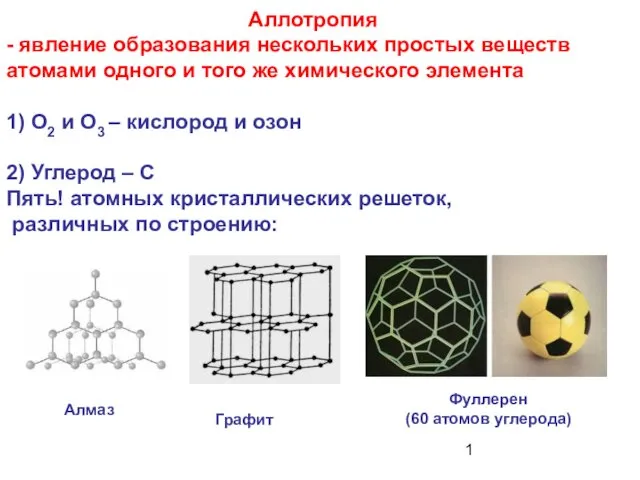 Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента
Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента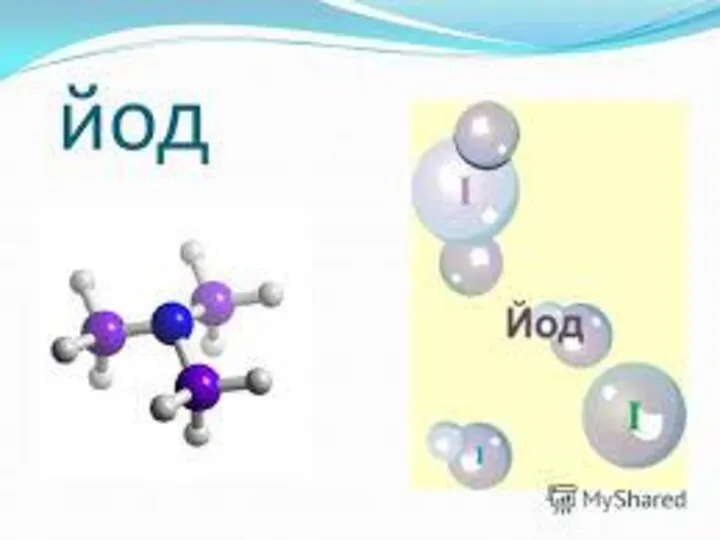 Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Кристалічний і аморфний стани твердих речовин
Кристалічний і аморфний стани твердих речовин Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Применение центрифугирования
Применение центрифугирования Кислоты
Кислоты Таблица Менделеева
Таблица Менделеева