Запах сернистого газа SO2 знает каждый, кто хоть раз зажигал спичку.
Этот газ хорошо растворяется в воде: в 1л воды можно растворить 42 л сернистого газа. Определите массу сернистого газа, которую можно растворить в 10 литрах воды.
Решение:
V=n*VM
Дано:
V1(SO2) = 42 л
н.у.
V1(Н2О) = 1 л
V2(Н2О) = 10 л
42 л SO2 растворяется в 1 л воды
х л SO2 -- в 10 л воды,
Решаем пропорцию
х = 42* 10/1 = 420 л
V(SO2) = 420 л
n (SO2) = 420л/ 22,4 л/моль = 18,75 моль
М(SO2 ) = 64 г/моль
n = V/VM
m = n* М
m (SO2) = 18,75 моль * 64 г/моль = 1200 г
Ответ: m (SO2) = 1200 г
----------------------
Найти:
m(SO2) = ?





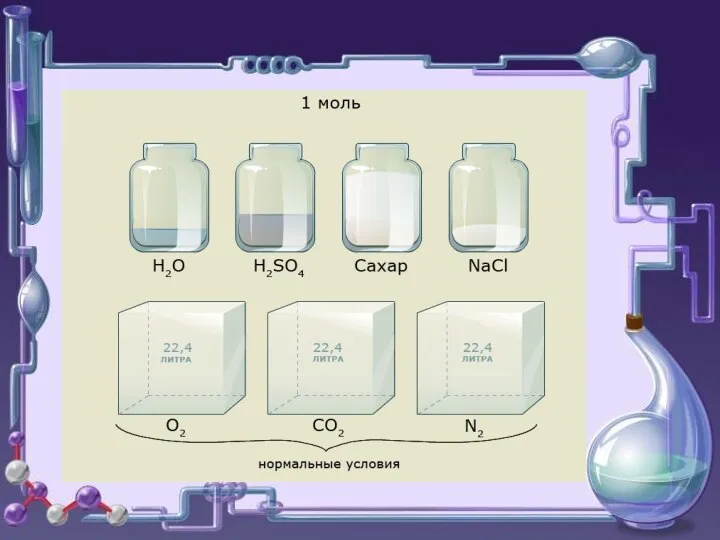




 Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Строение и электрический заряд коллоидных частиц. Электрокинетические явления
Строение и электрический заряд коллоидных частиц. Электрокинетические явления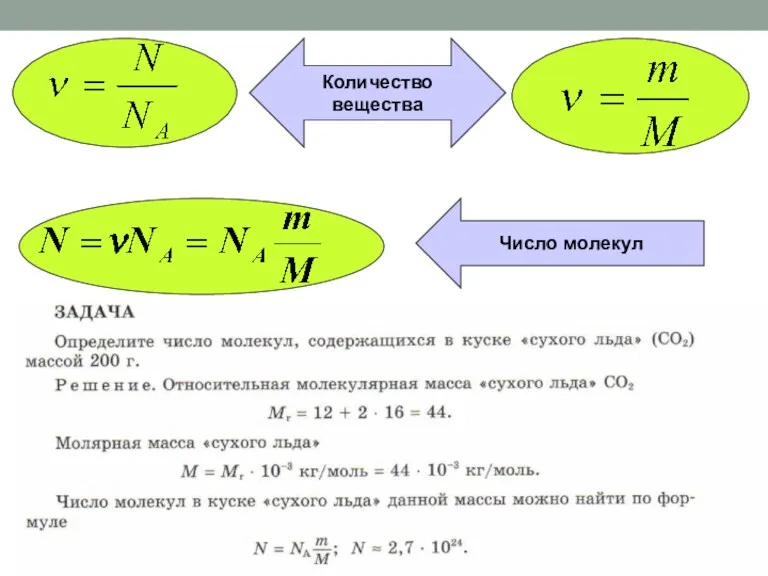 Количество вещества
Количество вещества Физические методы стабилизации масел
Физические методы стабилизации масел Химический элемент кремний
Химический элемент кремний Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Правила по технике безопасности в химической лаборатории
Правила по технике безопасности в химической лаборатории Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Влияние газированных напитков на организм человека
Влияние газированных напитков на организм человека ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ
ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ Химический факультет
Химический факультет Химиялық элемент оттегі
Химиялық элемент оттегі Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Ауыр металлдар
Ауыр металлдар ООО Ангарский Азотно-туковый завод. Основы производства аммиака
ООО Ангарский Азотно-туковый завод. Основы производства аммиака Основания. Номенклатура оснований
Основания. Номенклатура оснований Железо. Соединения железа
Железо. Соединения железа Біріншілік алкилсульфаттар және алкилэтоксисульфаттар немесе біріншілік спирттегі сульфоэфирдің тұздары. 4 Лекция
Біріншілік алкилсульфаттар және алкилэтоксисульфаттар немесе біріншілік спирттегі сульфоэфирдің тұздары. 4 Лекция Воздух и его состав
Воздух и его состав Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Химия в повседневной жизни человека
Химия в повседневной жизни человека Главная подгруппа IV группы
Главная подгруппа IV группы Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Свойства и биологическая роль карбонильных соединений
Свойства и биологическая роль карбонильных соединений