Содержание
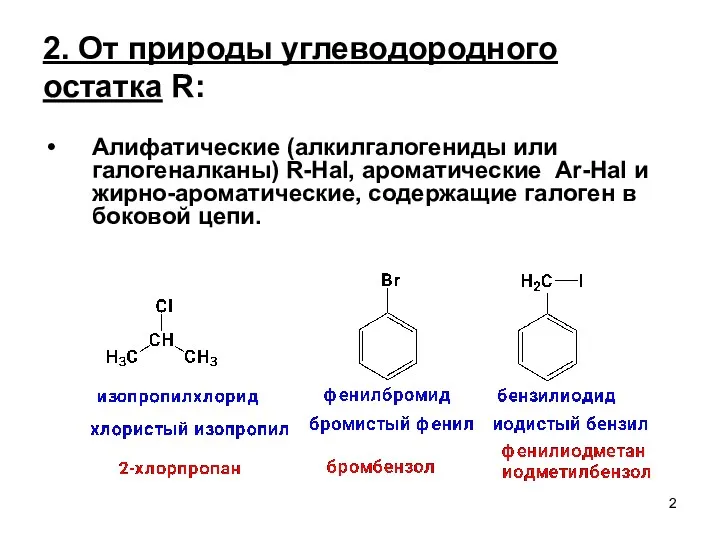
- 2. 2. От природы углеводородного остатка R: Алифатические (алкилгалогениды или галогеналканы) R-Hal, ароматические Ar-Hal и жирно-ароматические, содержащие
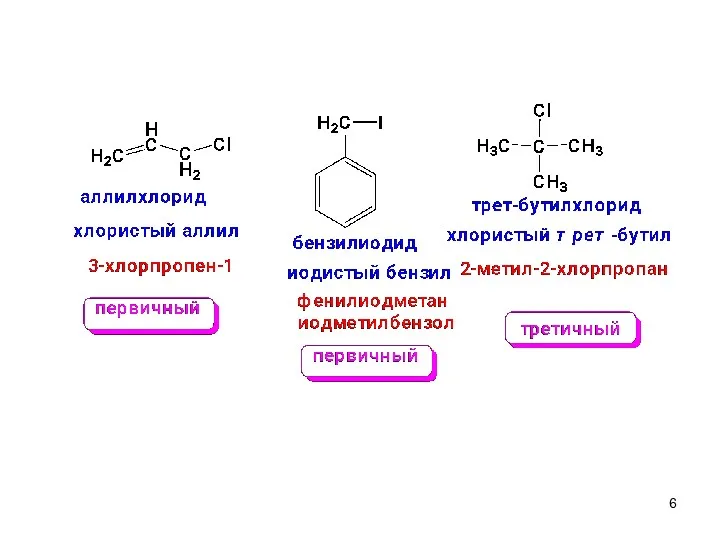
- 3. 3. По характеру С в sp3-гибридном состоянии, с которым связан галоген: Первичные – R-СН2- Hal, вторичные
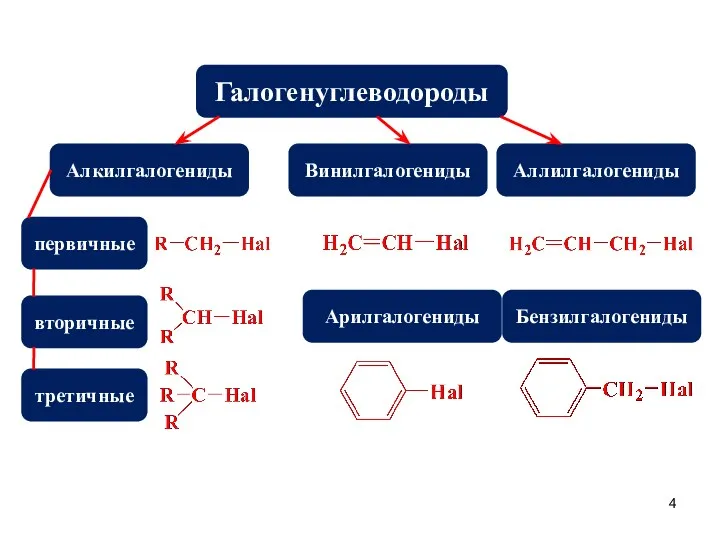
- 4. Галогенуглеводороды Алкилгалогениды Арилгалогениды Винилгалогениды Бензилгалогениды Аллилгалогениды первичные вторичные третичные
- 5. Номенклатура Радикально-функциональные названия: строятся путем прибавления названия галогена в форме прилагательного перед названием R, или после
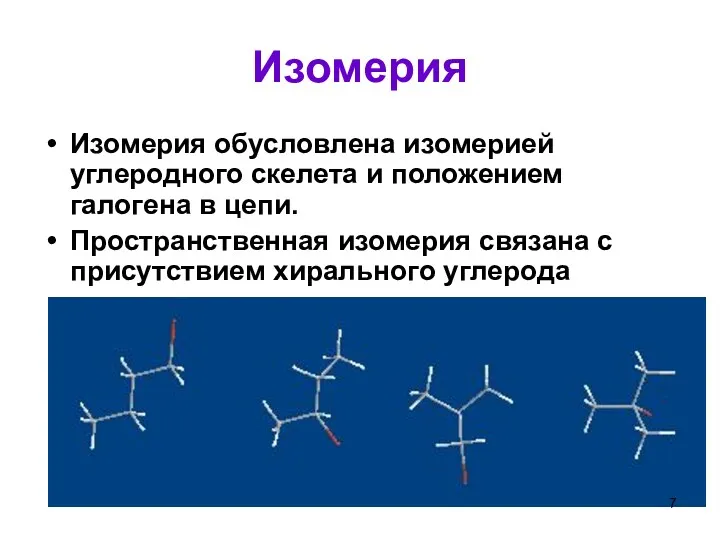
- 7. Изомерия Изомерия обусловлена изомерией углеродного скелета и положением галогена в цепи. Пространственная изомерия связана с присутствием
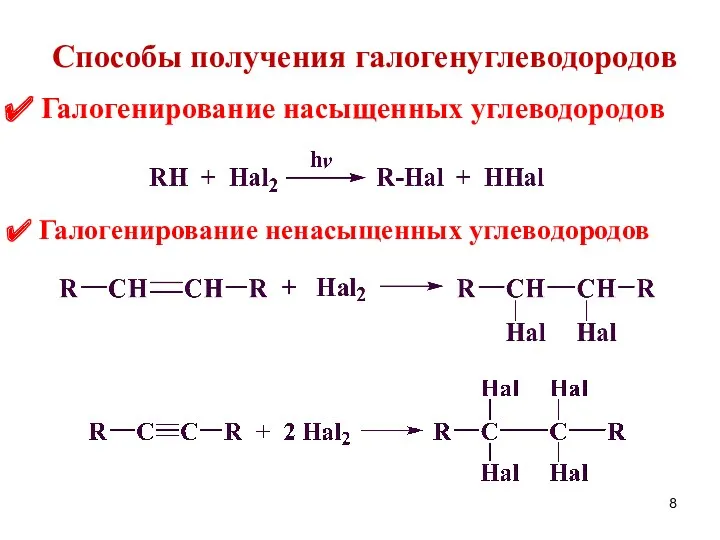
- 8. Способы получения галогенуглеводородов Галогенирование насыщенных углеводородов Галогенирование ненасыщенных углеводородов
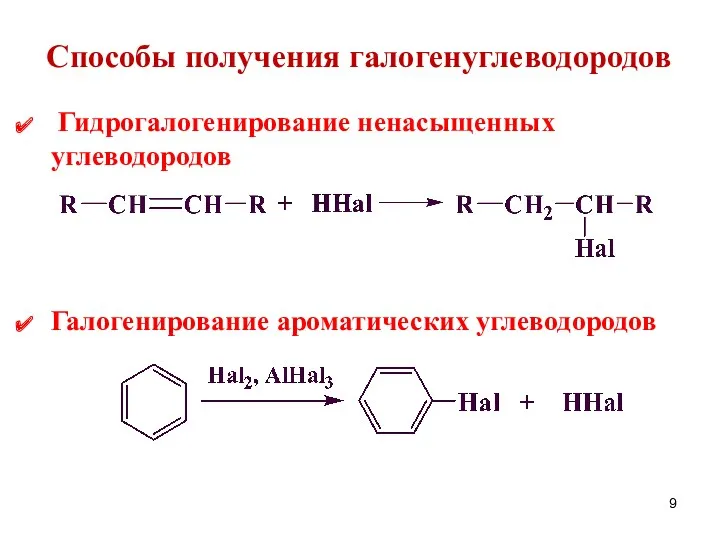
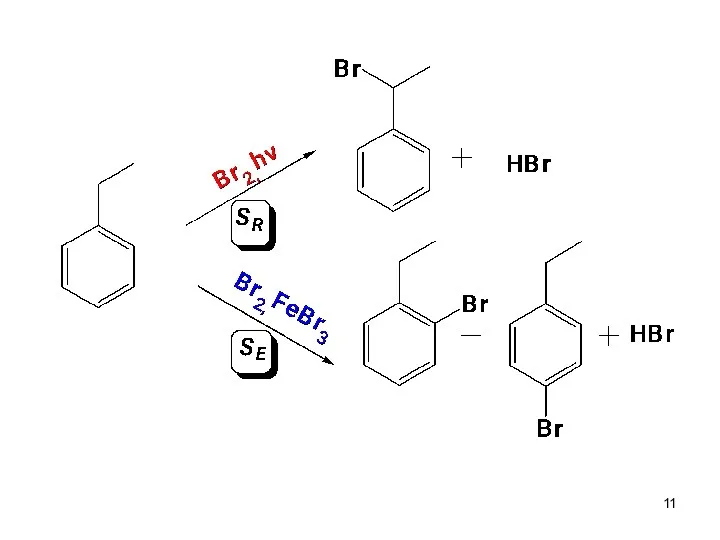
- 9. Способы получения галогенуглеводородов Гидрогалогенирование ненасыщенных углеводородов Галогенирование ароматических углеводородов
- 10. Способы получения галогенуглеводородов Замещение гидроксигруппы в спиртах на галоген Удобные реагенты для замещения ОН-группы в спиртах
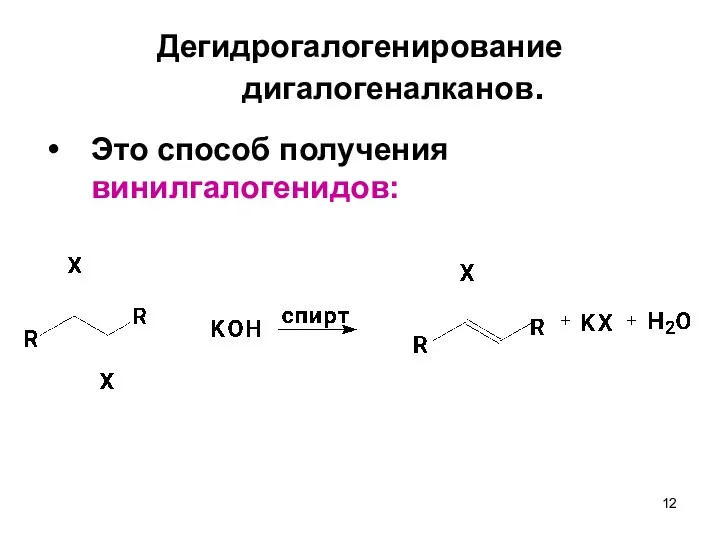
- 12. Дегидрогалогенирование дигалогеналканов. Это способ получения винилгалогенидов:
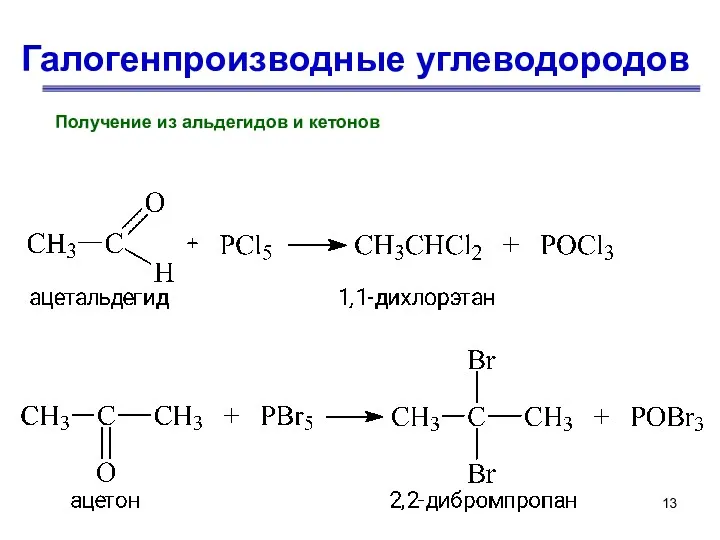
- 13. Галогенпроизводные углеводородов Получение из альдегидов и кетонов
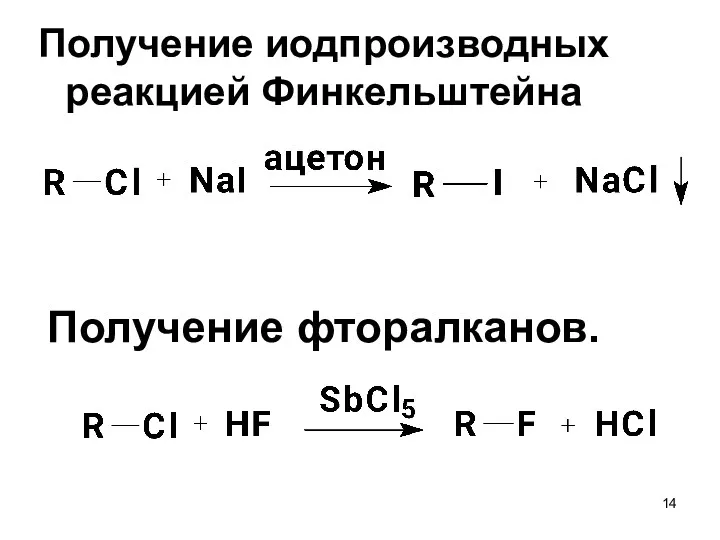
- 14. Получение иодпроизводных реакцией Финкельштейна Получение фторалканов.
- 15. ФИЗИЧЕСКИЕ СВОЙСТВА Физические свойства галогеналканов зависят от природы и числа атомов галогена в молекуле. Низшие и
- 16. Полифторалканы заметно отличаются по свойствам от других галогеналканов. Переход от одного галогена к другому заметно отражается
- 17. Галогеноуглеводороды – полярные соединения, но они почти нерастворимы в воде , так как не образуют с
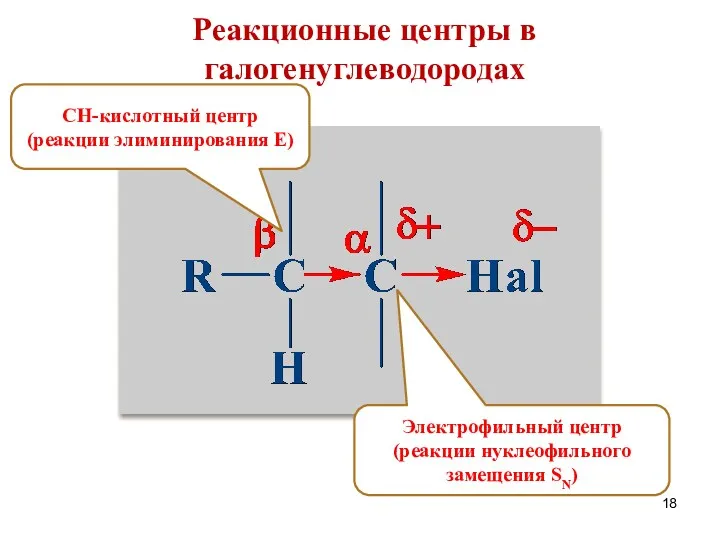
- 18. Реакционные центры в галогенуглеводородах Электрофильный центр (реакции нуклеофильного замещения SN) СН-кислотный центр (реакции элиминирования Е)
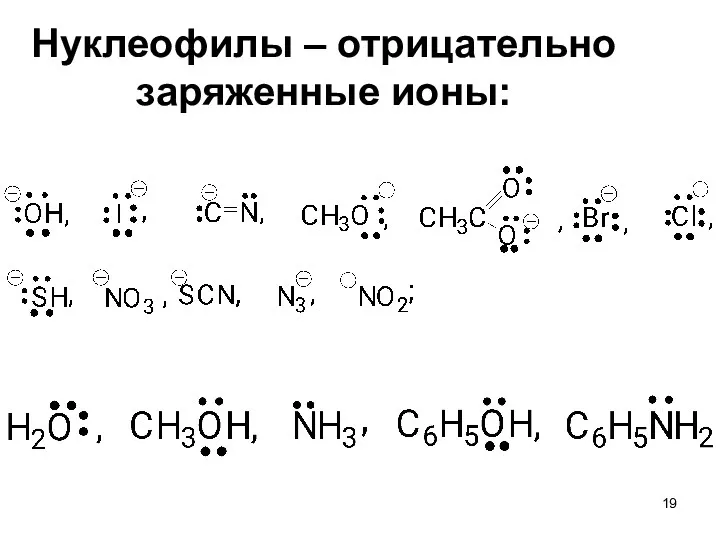
- 19. Нуклеофилы – отрицательно заряженные ионы:
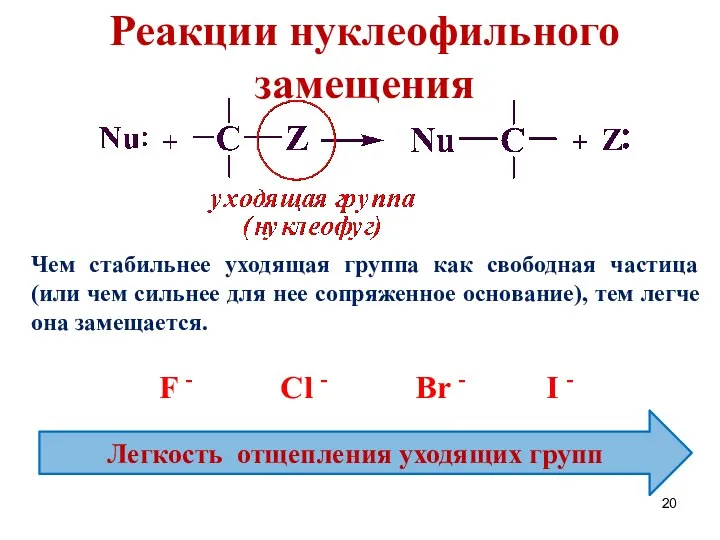
- 20. Реакции нуклеофильного замещения Чем стабильнее уходящая группа как свободная частица (или чем сильнее для нее сопряженное
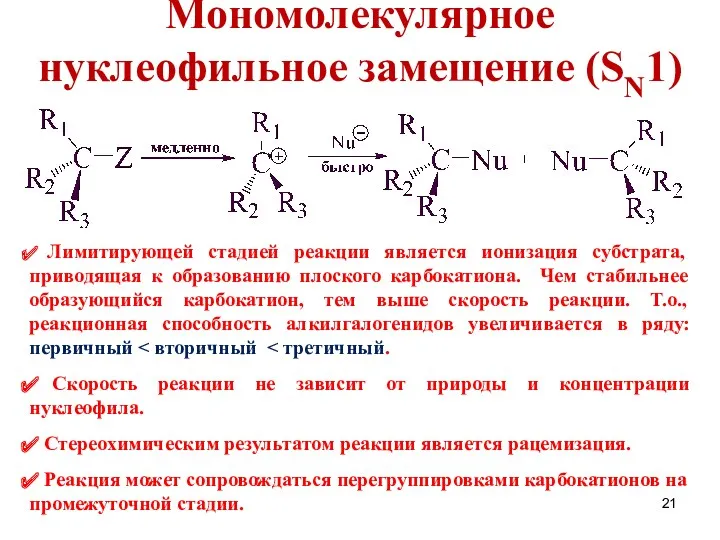
- 21. Мономолекулярное нуклеофильное замещение (SN1) Лимитирующей стадией реакции является ионизация субстрата, приводящая к образованию плоского карбокатиона. Чем
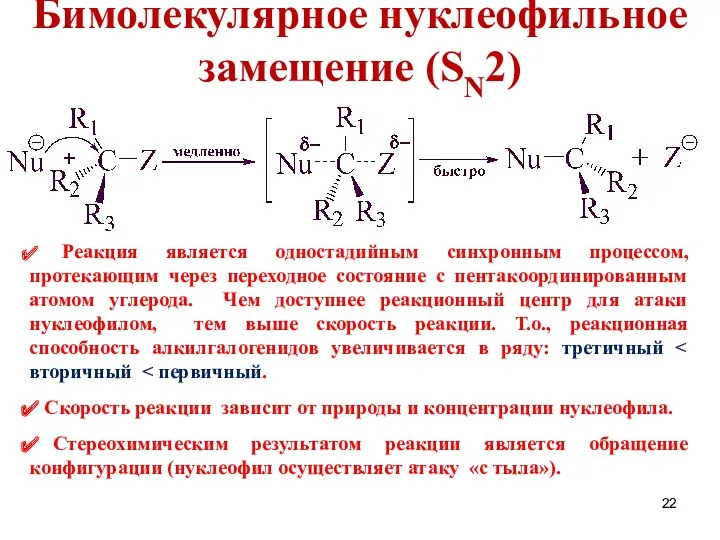
- 22. Бимолекулярное нуклеофильное замещение (SN2) Реакция является одностадийным синхронным процессом, протекающим через переходное состояние с пентакоординированным атомом
- 23. Нуклеофильность Нуклеофильность – это способность отдать пару электронов электрофильному атому углерода или другому положительно заряженному атому,
- 24. Влияние нуклеофильности реагента. Активность нуклеофила сказывается на скорости реакций типа SN2, поскольку он принимает участие в
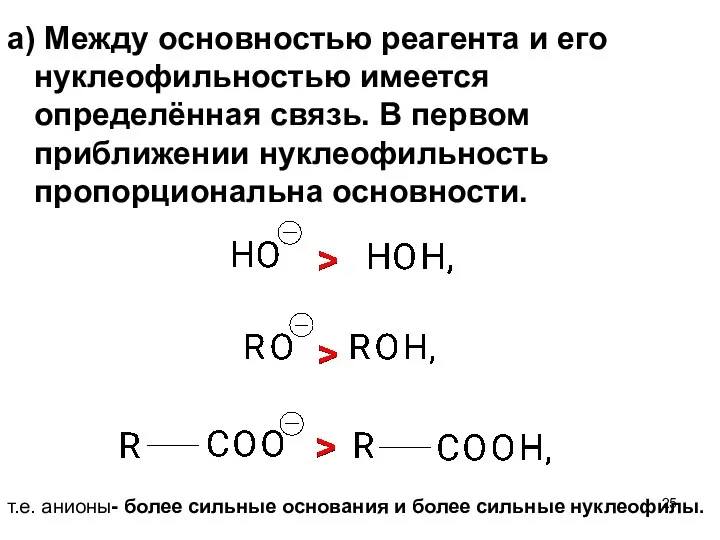
- 25. а) Между основностью реагента и его нуклеофильностью имеется определённая связь. В первом приближении нуклеофильность пропорциональна основности.
- 26. б) Нуклеофильность определяется ещё и поляризуемостью. Чем больше размер атома, тем выше его нуклеофильность. Легкополяризуемые реагенты
- 27. в) На нуклеофильность слабополяризуемых ионов значительное влияние оказывает природа растворителя. В полярных растворителях ионы находятся в
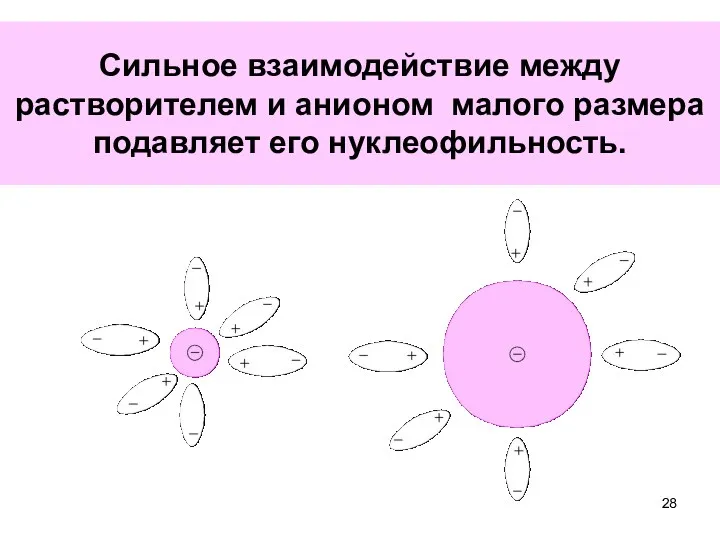
- 28. Сильное взаимодействие между растворителем и анионом малого размера подавляет его нуклеофильность.
- 29. Реагенты по возрастанию их нуклеофильности в SN2-реакциях в протонных растворителях можно расположить таким образом:
- 30. Апротонный растворитель не способен сольватировать анионы за счёт образования водородных связей с ними, поэтому анионы в
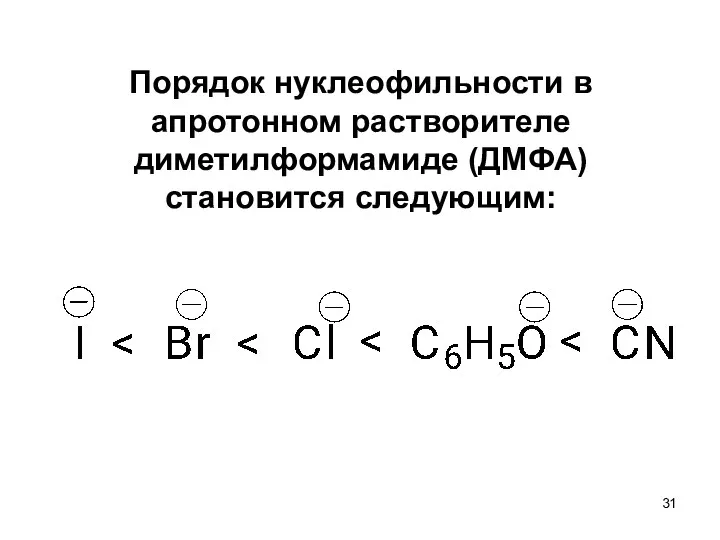
- 31. Порядок нуклеофильности в апротонном растворителе диметилформамиде (ДМФА) становится следующим:
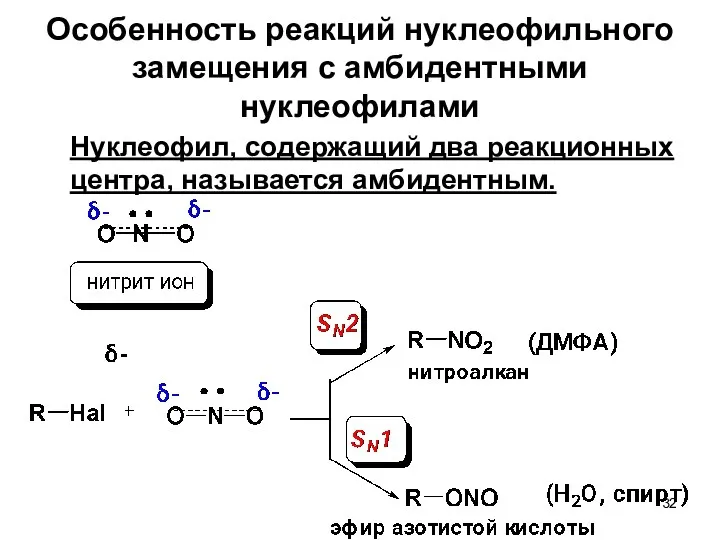
- 32. Особенность реакций нуклеофильного замещения с амбидентными нуклеофилами Нуклеофил, содержащий два реакционных центра, называется амбидентным.
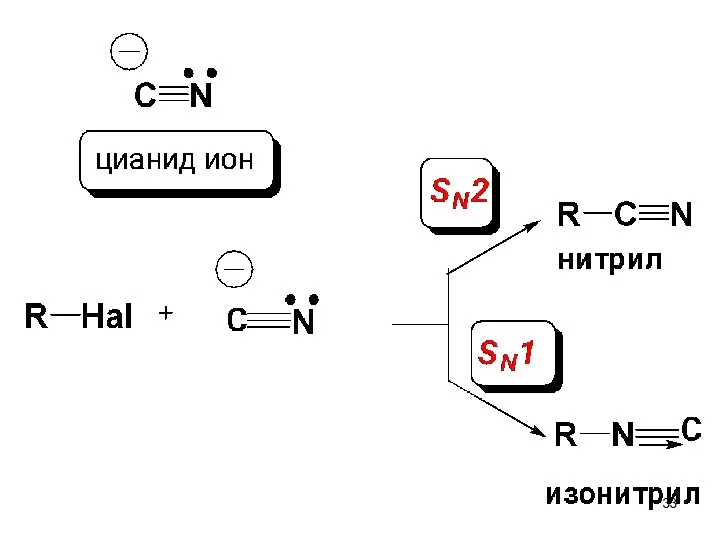
- 34. Правило Корнблюма: В SN2-реакциях атакующим атомом амбидентного нуклеофила будет более нуклеофильный атом, а в SN1-реакциях –
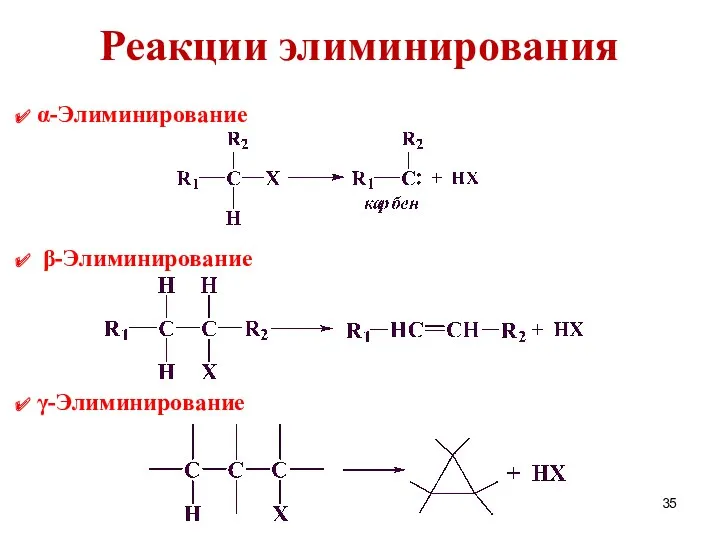
- 35. Реакции элиминирования α-Элиминирование β-Элиминирование γ-Элиминирование
- 36. Мономолекулярное элиминирование Е1 Лимитирующей стадией реакции является ионизация субстрата. Реакционная способность алкилгалогенидов увеличивается в ряду: первичный
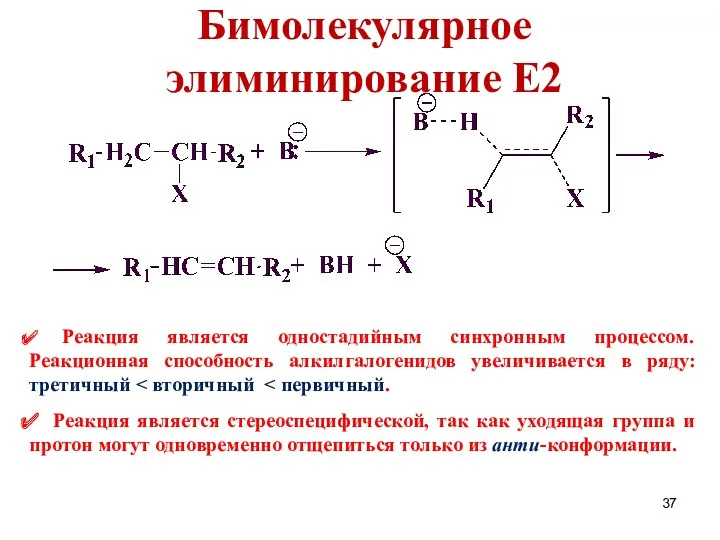
- 37. Бимолекулярное элиминирование Е2 Реакция является одностадийным синхронным процессом. Реакционная способность алкилгалогенидов увеличивается в ряду: третичный Реакция
- 38. Конкурентность реакций SN и E В более полярных растворителях предпочтительнее протекают реакции нуклефильного замещения, чем элиминирования
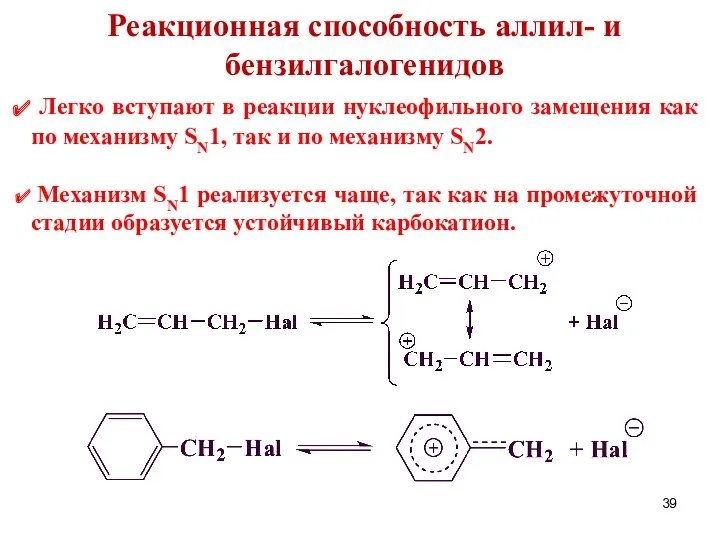
- 39. Реакционная способность аллил- и бензилгалогенидов Легко вступают в реакции нуклеофильного замещения как по механизму SN1, так
- 40. Реакционная способность винил- и арилгалогенидов Винил- и арилгалогениды содержат атом галогена, находящийся в сопряжении с кратной
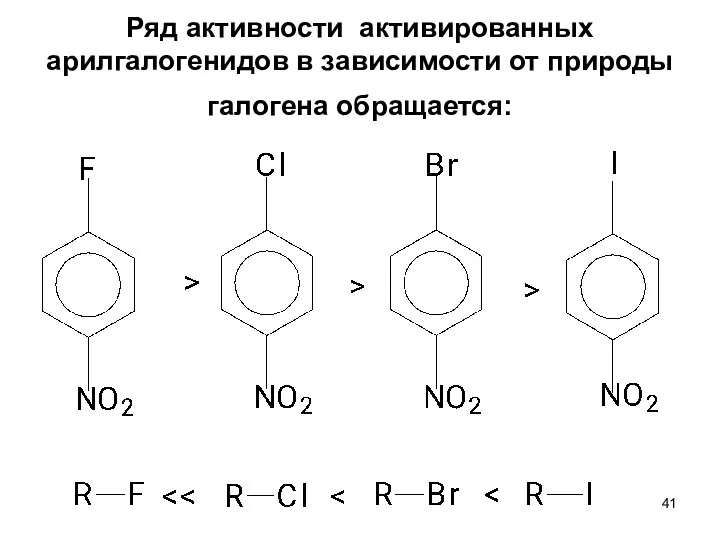
- 41. Ряд активности активированных арилгалогенидов в зависимости от природы галогена обращается:
- 42. 3.РЕАКЦИИ ГАЛОГЕНПРОИЗВОДНЫХ С МЕТАЛЛАМИ Алкил- и арилгалогениды реагируют с металлами с образованием металлоорганических соединений. Происходит образование
- 43. Li образует ковалентную связь с угдеродом, в то время как Na-производные в основном ионные соединения. Они
- 44. При переходе от R-Ha1 к Li - и Na-органическим соединениям происходит обращение поляризации атома углерода от
- 45. Mg-органические галогениды –реактивы Гриньяра ( 1912 г. Нобелевская премия). Роль диэтилового эфира : 1) эфир растворяет
- 46. Реакции магнийорганических соединений. В реактивах Гриньяра связь достаточно полярна, что определяет карбанионный характер атома углерода ,
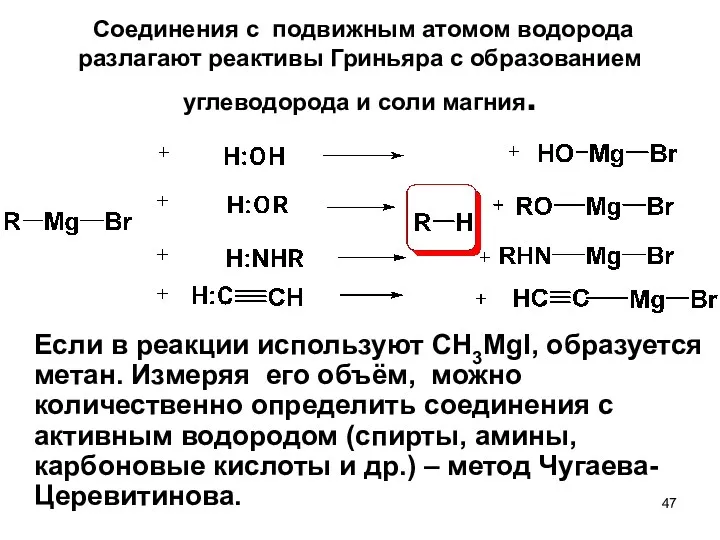
- 47. Соединения с подвижным атомом водорода разлагают реактивы Гриньяра с образованием углеводорода и соли магния. Если в
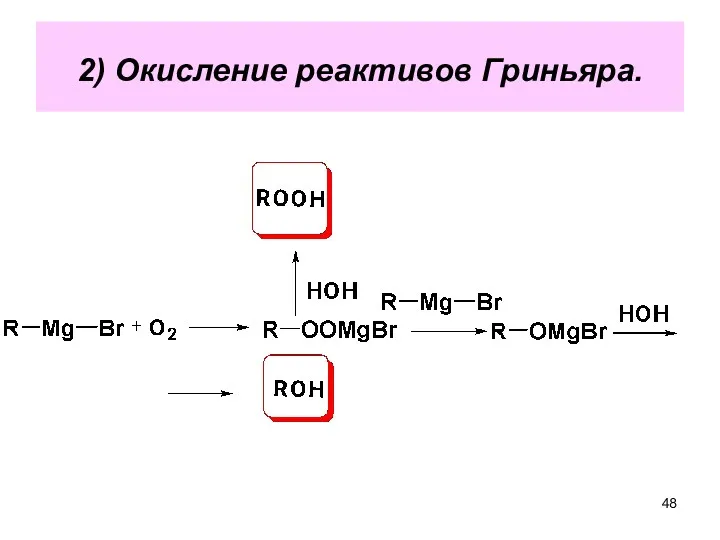
- 48. 2) Окисление реактивов Гриньяра.
- 50. Скачать презентацию





















 Вода - основа жизни
Вода - основа жизни Нитраттарды қолдану
Нитраттарды қолдану Полимеры органические и неорганические
Полимеры органические и неорганические Своя игра. Химия. 7 класс
Своя игра. Химия. 7 класс Гетероциклические соединения
Гетероциклические соединения Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Ароматические кислоты фенолокислоты
Ароматические кислоты фенолокислоты Оксид цинка
Оксид цинка Щелочи
Щелочи Спирты
Спирты Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов
Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов Полимеры
Полимеры Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Спирты. Понятие о спиртах
Спирты. Понятие о спиртах Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Общая характеристика халькогенов. Кислород
Общая характеристика халькогенов. Кислород Чистые вещества и смеси
Чистые вещества и смеси Формальдегід. Будова та шкідливість
Формальдегід. Будова та шкідливість Алкадиены, нафтены
Алкадиены, нафтены Химическая связь в кластерах
Химическая связь в кластерах Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения
Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения Электрокинетические свойства дисперсных систем
Электрокинетические свойства дисперсных систем Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год
Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Подгруппа углерода
Подгруппа углерода Комплексонометрлік титрлеу
Комплексонометрлік титрлеу