Слайд 2

Щелочами называются растворимые в воде сильные основания.
Рассмотрим еще раз типичные реакции
нейтрализации между щелочью и кислотой при помощи структурных формул:
Слайд 3

Обычно к щёлочам относят. гидроксиды щелочных и щел.-зем. металлов. Бесцв. кристаллы.
Гидроксиды щелочных металлов - едкие щелочи -хорошо раств. в воде (хуже - LiOH), гидроксиды щел.-зем. металлов - плохо. Сила оснований и р-римость в воде в каждой группе периодич. системы возрастают сверху вниз с увеличением радиуса катиона. Едкие щёлочи раств. также в этаноле и метаноле. Едкие щёлочи (за исключением LiOH) термически устойчивы до т-ры выше 1000 °С, гидроксиды щел.-зем. металлов и LiOH разлагаются при более низких т-рах.
Слайд 4

Щёлочи жадно поглощают из воздуха воду, СО2, SO2, H2S и NO2.
Если не принимать мер предосторожности, они всегда будут содержать кристаллизационную воду, примесь карбоната, сульфата, сульфида, нитрата и нитрита. Для обезвоживания щёлочи нагревают в атмосфере, свободной от СО2, едкие щёлочи освобождают от примеси карбоната перекристаллизацией из этанола. Водные р-ры едких щёлочей разрушают стекло, расплавы - фарфор и платину. Плавят едкие щёлочи в сосудах из серебра, никеля или железа, хранят в полиэтиленовых сосудах. Р-ры едких щёлочей нельзя долго хранить в стеклянных сосудах с пришлифованными стеклянными пробками и кранами, к-рые прилипают к шлифу вследствие взаимод. щёлочей со стеклом.
Слайд 5

Получают: едкие щёлочи- электролизом хлоридов щелочных металлов, обменными р-циями между солями
щелочных металлов и гидроксидами щел.-зем. металлов; действием воды на оксиды щел.-зем. металлов. Определяют щёлочи с помощью кислотно-основных индикаторов.
Твердые щёлочи и их конц. р-ры разрушают живые ткани, особенно опасно попадание частиц твердой щёлочи в глаза.




 Кислород. Распространение кислорода в природе (8 класс)
Кислород. Распространение кислорода в природе (8 класс) Электролиз веществ
Электролиз веществ Основные понятия и законы химии. Тема1
Основные понятия и законы химии. Тема1 Карбоновые кислоты
Карбоновые кислоты Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ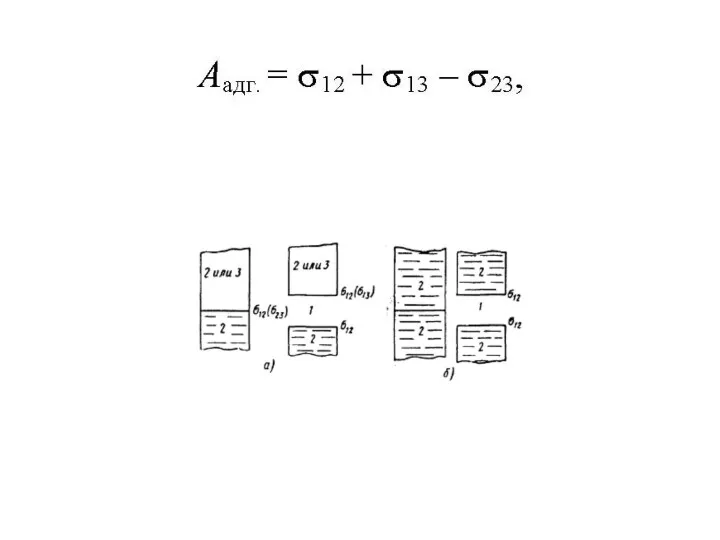 Характер затвердевания
Характер затвердевания Взаимодействия кислорода с металлом
Взаимодействия кислорода с металлом Радиоактивные элементы почв
Радиоактивные элементы почв Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Металлы применяемые в строительстве
Металлы применяемые в строительстве Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ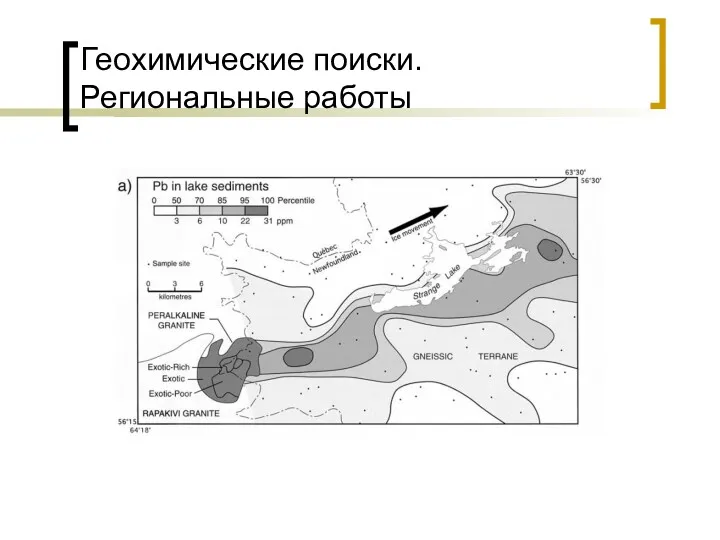 Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы ЭЛЕКТРОЛИТЫ
ЭЛЕКТРОЛИТЫ Составление формул молекулярных простых веществ
Составление формул молекулярных простых веществ МЕТОДЫ ОЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ
МЕТОДЫ ОЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Кислотность и основность органических соединений. (Лекция 3)
Кислотность и основность органических соединений. (Лекция 3) Валентность химических элементов
Валентность химических элементов Составление химических формул бинарных соединений по степени окисления атомов
Составление химических формул бинарных соединений по степени окисления атомов Electroanalytical Chemistry
Electroanalytical Chemistry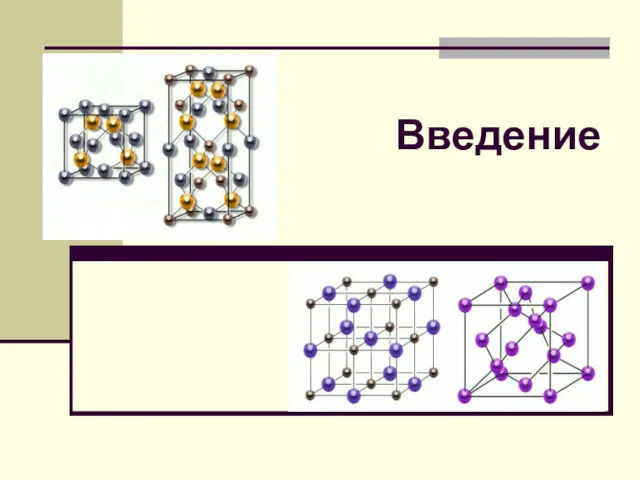 Кристаллохимия как наука
Кристаллохимия как наука IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)
IVA группа С, Si, Ge, Sn, Pb (подгруппа титана) Параметры токсичности продуктов горения материала. (Задача 3)
Параметры токсичности продуктов горения материала. (Задача 3) Природный и попутный нефтяной газы
Природный и попутный нефтяной газы