Содержание
- 2. Закон Гесса.
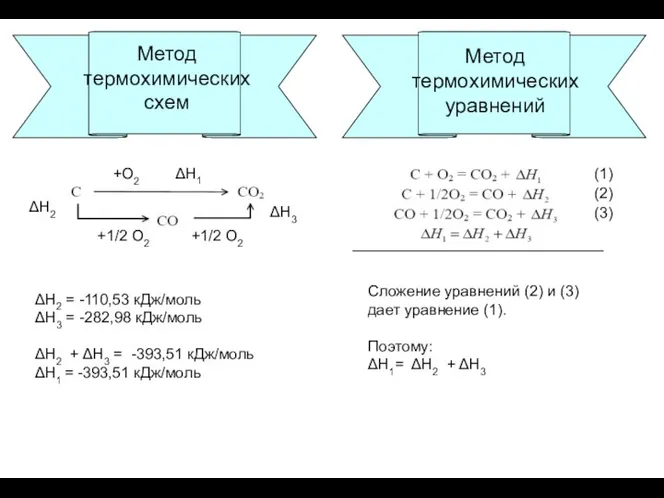
- 3. Применение закона Гесса Метод термохимических уравнений Метод термохимических схем Метод термохимических уравнений
- 4. Метод термохимических схем ΔН1 ΔН2 ΔН3 +О2 +1/2 О2 +1/2 О2 ΔН2 = -110,53 кДж/моль ΔН3
- 5. Следствия из закона Гесса.
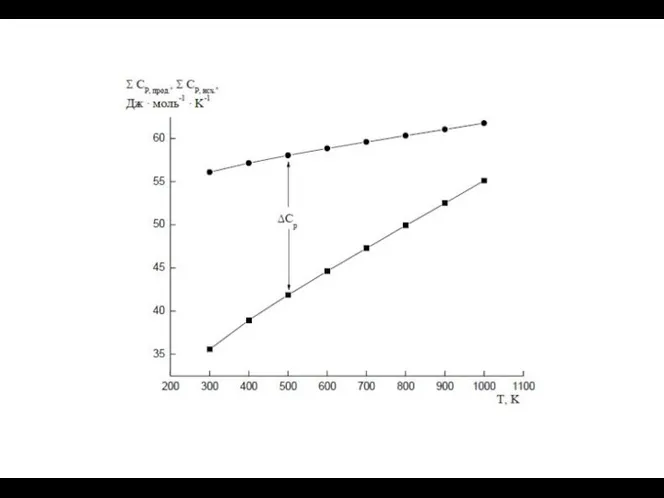
- 7. Зависимость тепловых эффектов химических реакций от температуры. Теплоемкость. Уравнение Кирхгофа.
- 8. Расчеты тепловых эффектов реакций на основе следствий из закона Гесса с использованием справочных термодинамических данных ограничены
- 9. Средние теплоемкости измеряются на определенном интервале температур Истинные теплоемкости соответствуют бесконечно малому изменению температуры Изобарная теплоемкость
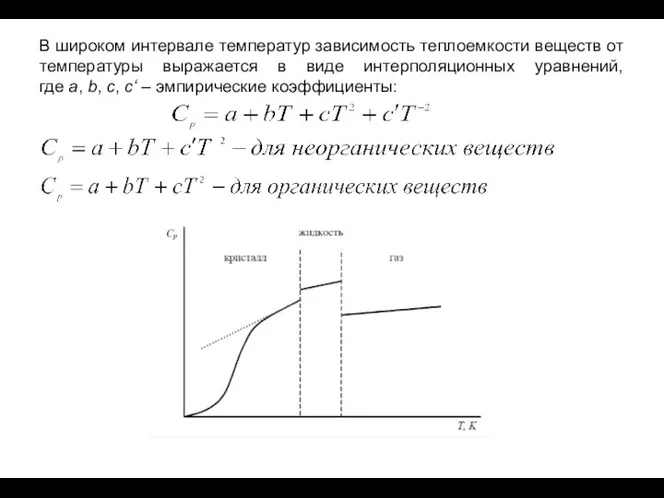
- 10. В широком интервале температур зависимость теплоемкости веществ от температуры выражается в виде интерполяционных уравнений, где a,
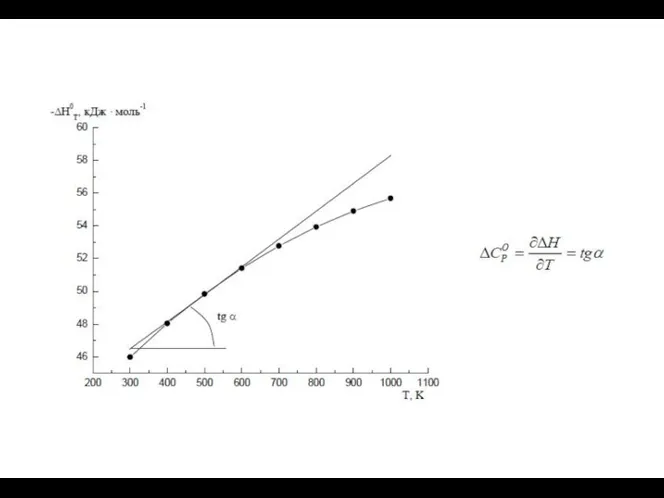
- 11. Уравнение Кирхгофа и его интегрирование
- 12. На практике интегрирование обычно проводят от стандартной температуры 298 К до заданной Т, при которой протекает
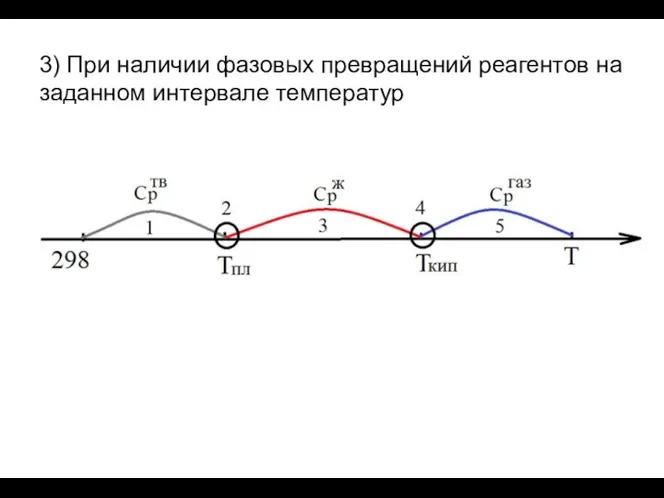
- 17. 3) При наличии фазовых превращений реагентов на заданном интервале температур
- 18. Процессы: изобарное нагревание твердого вещества от 298К до ТПЛ плавление твердого вещества при ТПЛ изобарное нагревание
- 19. МВЗ № 4 , гл. «Первое начало термодинамики»
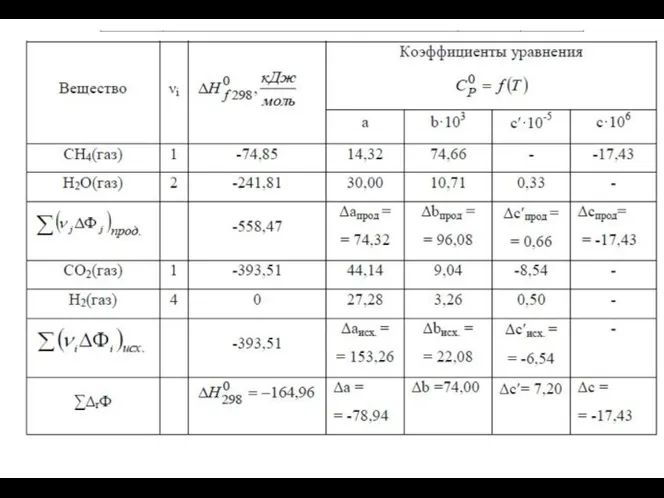
- 22. В задаче рассматриваются три метода расчета изменения теплоемкости в химической реакции как функции температуры, которые при
- 28. Скачать презентацию



















 Общая характеристика неметаллов
Общая характеристика неметаллов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Аморфные сплавы
Аморфные сплавы Электролиз. Классификация
Электролиз. Классификация Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы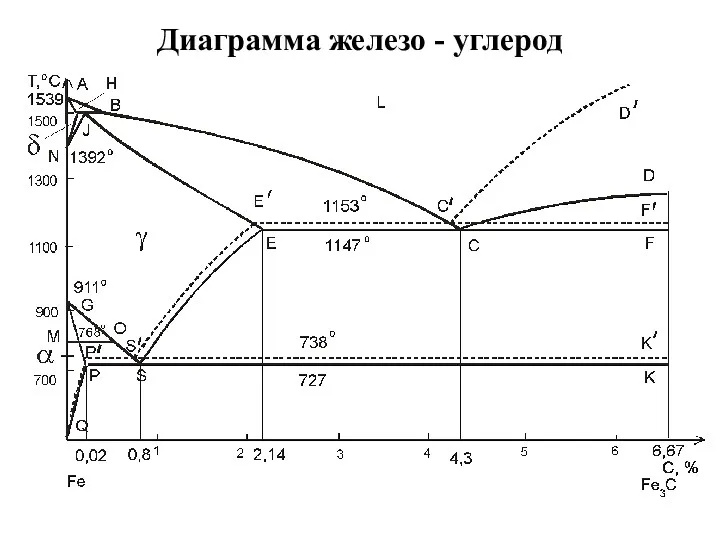 Диаграмма железо - углерод
Диаграмма железо - углерод Хром. Химиялық қасиеттері
Хром. Химиялық қасиеттері Анализ 3% раствора водорода пероксида
Анализ 3% раствора водорода пероксида Alkynes
Alkynes Металлическая связь
Металлическая связь Аминокислоты алифатического ряда и их производные
Аминокислоты алифатического ряда и их производные Комплексные соединения
Комплексные соединения Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів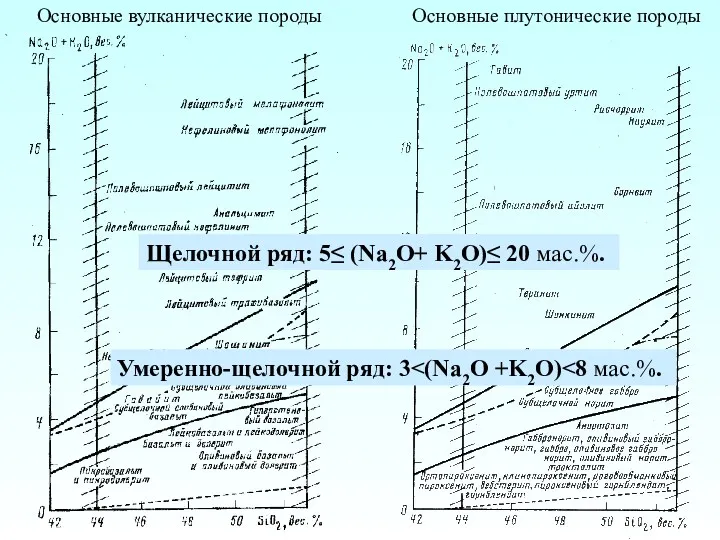 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Утворення асимілятів та їхнє перетворення
Утворення асимілятів та їхнє перетворення Технология промышленных газов
Технология промышленных газов Кислотно-основное титрование
Кислотно-основное титрование Химические свойства алкенов
Химические свойства алкенов Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Элементы пятой-А группы. Азот и фосфор
Элементы пятой-А группы. Азот и фосфор Анілін. Фізичні властивості
Анілін. Фізичні властивості Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар
Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар Анализ анионов. Анализ смеси солей
Анализ анионов. Анализ смеси солей Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества 20230419_oksidy
20230419_oksidy