Слайд 2

Алкены химически активны. Их химические свойства во многом определяются наличием двойной
связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны. Алкены легко вступают в реакции окисления, присоединения а также способны к алильному радикальному замещению.
Слайд 3

РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Галогенирование(присоединение галогенов)
Алкены легко при обычных условиях вступают в реакции с
хлором и бромом с образованием соответствующих дигалогеналканов, в которых атомы галогена находятся у соседних атомов углерода
CH2 = CH2 + Br2 → CH2Br – CH2Br
Слайд 4

Гидрирование(присоединение водорода)
Гидрирование к алкенам проводят в присутствии катализаторов. Чаще всего используют
измельченные металлы - платину, никель, палладий и др. В результате образуются соответствующие алканы (насыщенные углеводороды)
CH2 = CH2 + H2 → CH3 – CH3
Слайд 5
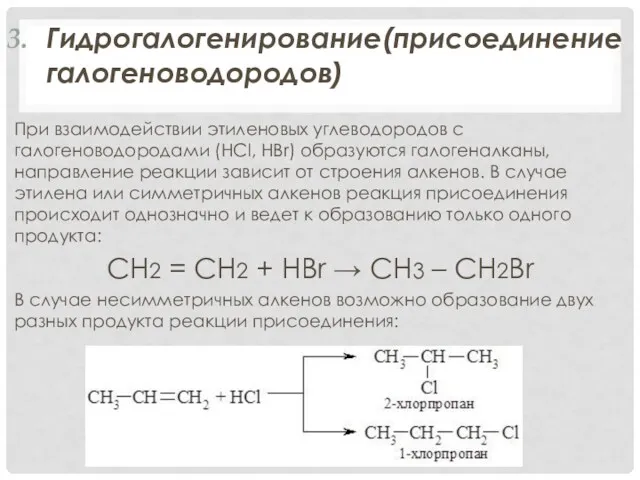
Гидрогалогенирование(присоединение галогеноводородов)
При взаимодействии этиленовых углеводородов с галогеноводородами (HCl, HBr) образуются галогеналканы,
направление реакции зависит от строения алкенов. В случае этилена или симметричных алкенов реакция присоединения происходит однозначно и ведет к образованию только одного продукта:
CH2 = CH2 + HBr → CH3 – CH2Br
В случае несимметричных алкенов возможно образование двух разных продукта реакции присоединения:
Слайд 6

Гидратация(присоединение воды)
Гидратация алкенов происходит в присутствии минеральных кислот и подчиняется правилу
Марковникова. Продуктами реакции являются спирты
CH2 = CH2 + H2O → CH3 – CH2 - OH
Слайд 7

РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
Молекулы алкенов способны присоединяться при определенных условиях друг к другу
с раскрытием π-связей и образования димеров, триммеров или высокомолекулярных соединений - полимеров. Полимеризация алкенов может протекать как по свободнорадикальному, так и катионно-анионому механизму. Как инициаторы полимеризации применяют кислоты, перекиси, металлы и др. Реакцию полимеризации осуществляют также под действием температуры, облучения, давления. Типичным примером является полимеризация этилена с образованием полиэтилена
nCH2 = CH2 → (-CH2 – CH2 -)n
Слайд 8

РЕАКЦИИ ОКИСЛЕНИЯ
Горение(взаимодействие с кислородом)
При горении алкенов образуются вода и углекислый газ
(полное окисление):
2C3H6 + 9O2 → 6CO2 ↑ + 6H2O
При недостатке кислорода алкены окисляются до CO или С:
C3H6 + 3O2(нед.) = 3CO ↑ + 3H2O







 Хімічні властивості металів
Хімічні властивості металів Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Материаловедение. Основные задачи материаловедения
Материаловедение. Основные задачи материаловедения Электролитическая диссоциация. Вещества в растворах
Электролитическая диссоциация. Вещества в растворах Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов Фосфор. Урок в 9 классе
Фосфор. Урок в 9 классе Химические свойства кислот
Химические свойства кислот Кристаллические решетки
Кристаллические решетки Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Хром. Физические и химические свойства
Хром. Физические и химические свойства Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері
Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері Химический факультет
Химический факультет Химия как компонент системы естественнонаучного образования
Химия как компонент системы естественнонаучного образования Cromatografia ionică
Cromatografia ionică Основні класи неорганічних сполук
Основні класи неорганічних сполук Алюминий и сплавы на его основе
Алюминий и сплавы на его основе Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Как и где используется соляная кислота
Как и где используется соляная кислота Электрохимические процессы
Электрохимические процессы Кислород. Атом кислорода
Кислород. Атом кислорода Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода
Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода Гранулометрический состав горных пород
Гранулометрический состав горных пород Дезодоранты. Антиперспиранты
Дезодоранты. Антиперспиранты Полимерные растворы. Условия образования
Полимерные растворы. Условия образования Химиялық тепе-теңдік
Химиялық тепе-теңдік Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов