Содержание
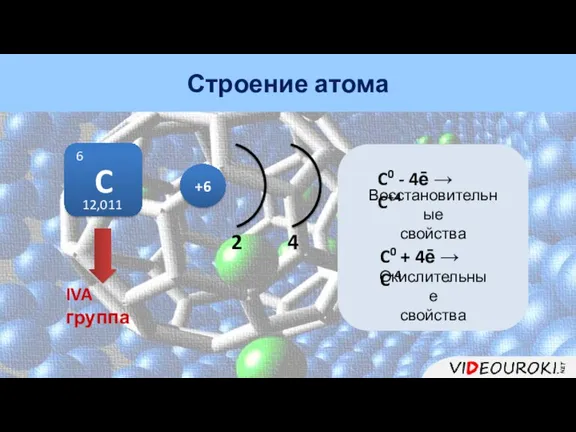
- 2. 2 4 C 6 12,011 IVA группа C0 - 4ē → C+4 C0 + 4ē →
- 3. Аллотропные модификации углерода Алмаз – прозрачное кристаллическое вещество. Одно из самых твёрдых веществ в природе. У
- 4. Слово «алмаз» происходит от арабского алмас, что означает «твердейший», или от греческого слова адамас – «несокрушимый,
- 5. 1 карат соответствует 0,2 г Огранённые прозрачные алмазы называют бриллиантами.
- 6. Короны царей Орден Святого Андрея Первозванного
- 7. Алмаз «Куллинан» Алмаз «Шах»
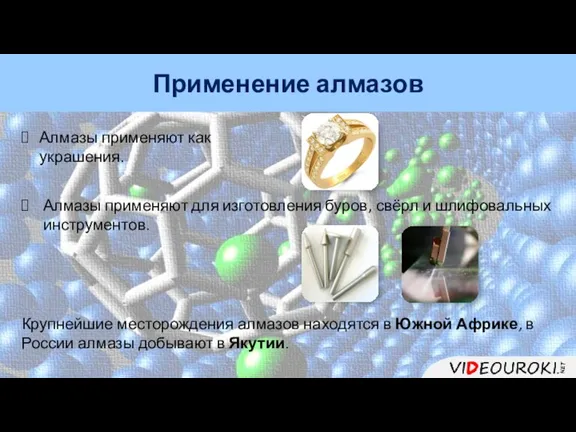
- 8. Применение алмазов Алмазы применяют как украшения. Алмазы применяют для изготовления буров, свёрл и шлифовальных инструментов. Крупнейшие
- 9. Аллотропные модификации углерода Графит — тёмно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском. Графит мягкий
- 10. Применение графита 1 2 3 4 1. электроды 2. твёрдые смазки 3. замедлители нейтронов в ядерных
- 12. Сажа и древесный уголь Древесный уголь получают при сухой перегонке древесины. Древесный уголь обладает адсорбцией. Из
- 13. Н.Д. Зелинский Очистки спирта от сивушных масел. Очистки сахарного сиропа от окрашенных веществ. Улавливание бензина из
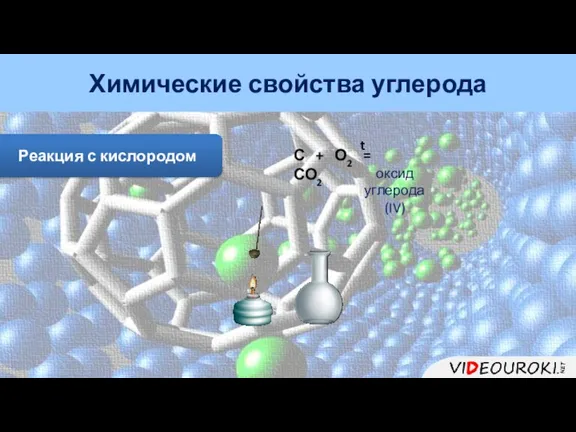
- 14. Реакция с кислородом Химические свойства углерода С + О2 = СО2 t оксид углерода (IV)
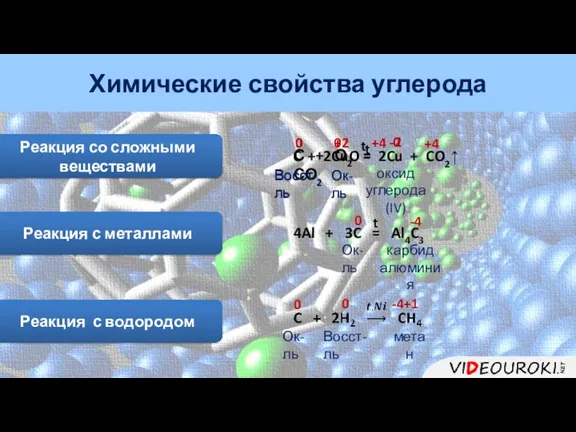
- 15. Реакция с кислородом Химические свойства углерода С + О2 = СО2 t 0 +4 -2 Восст-ль
- 16. Применение углерода
- 17. Нахождение в природе CaCO3 CO2
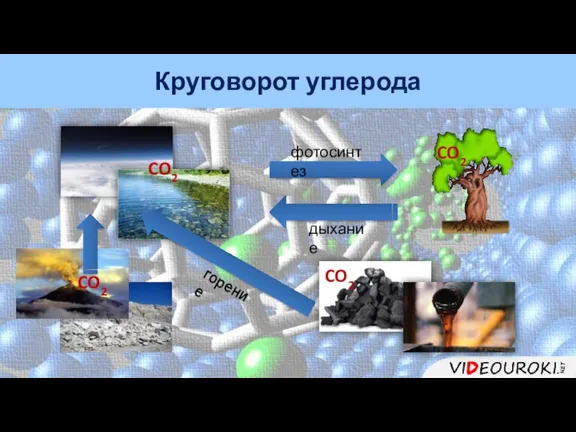
- 18. Круговорот углерода фотосинтез дыхание горение CO2 CO2 CO2 CO2
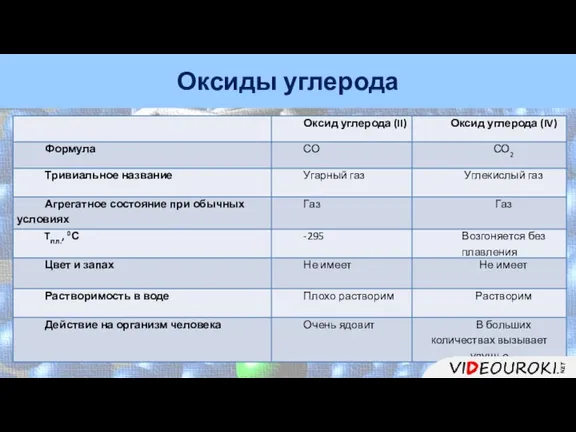
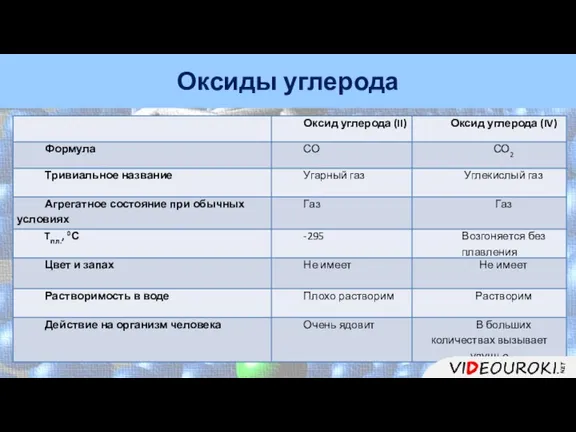
- 19. Оксиды углерода
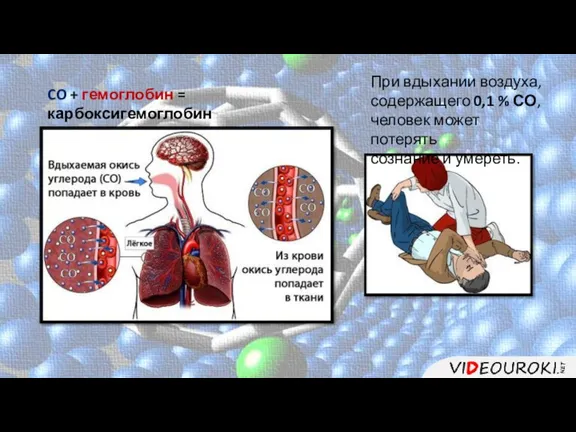
- 20. CO + гемоглобин = карбоксигемоглобин При вдыхании воздуха, содержащего 0,1 % СО, человек может потерять сознание
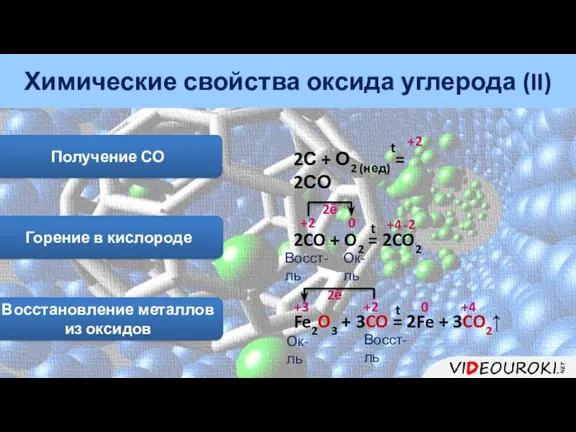
- 21. Химические свойства оксида углерода (II) Получение СО 2С + О2 (нед) = 2СО +2 Горение в
- 22. Оксиды углерода
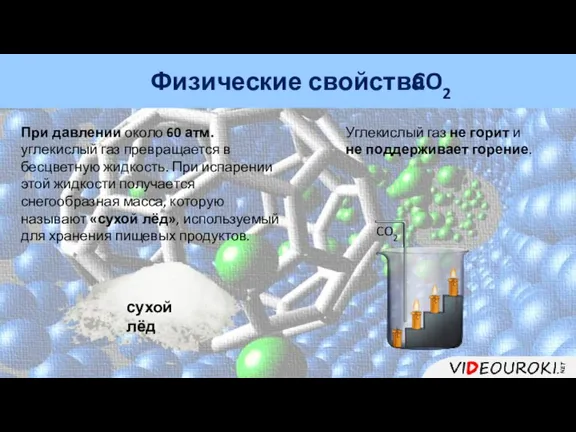
- 23. сухой лёд При давлении около 60 атм. углекислый газ превращается в бесцветную жидкость. При испарении этой
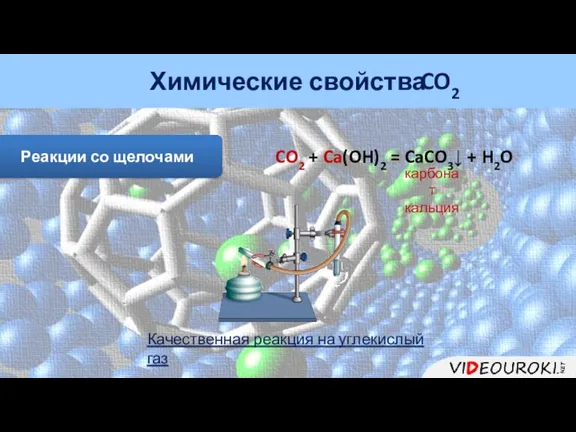
- 24. Химические свойства CO2 Реакции со щелочами CO2 + Ca(OH)2 = CaCO3↓ + H2O карбонат кальция Качественная
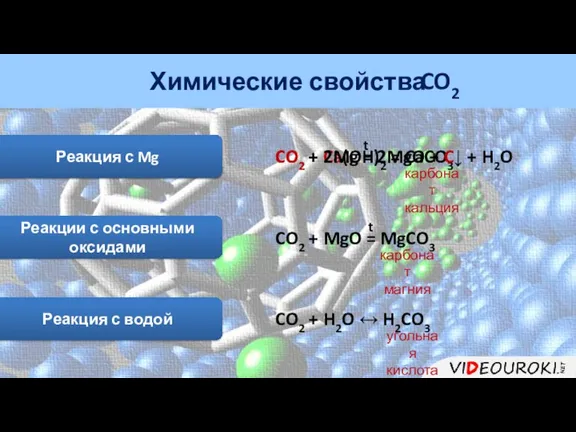
- 25. Химические свойства CO2 Реакции со щелочами CO2 + Ca(OH)2 = CaCO3↓ + H2O карбонат кальция Реакции
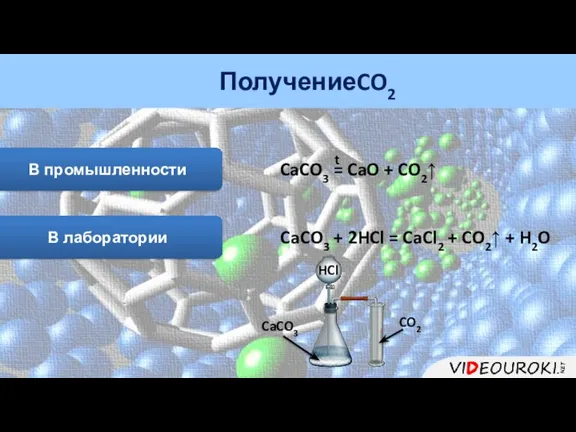
- 26. Получение CO2 В промышленности CaCO3 = CaO + CO2↑ t В лаборатории CaCO3 + 2HCl =
- 27. Применение CO2 1 2 3 4 5 1. изготовление шипучих напитков 2. получение соды 3. создание
- 28. Выводы Углерод – элемент IVA группы. На внешнем энергетическом уровне у углерода 4 электрона. Для углерода
- 30. Скачать презентацию














 Рождение органической химии
Рождение органической химии Химические свойства металлов
Химические свойства металлов Чистые вещества и смеси
Чистые вещества и смеси Осмий. Нахождение в природе
Осмий. Нахождение в природе Корбонаттар көмір қышқылынның тұздары
Корбонаттар көмір қышқылынның тұздары Соли. Свойства солей
Соли. Свойства солей Кобальт. Нахождение в природе. Получение
Кобальт. Нахождение в природе. Получение Бутадиеновые каучуки
Бутадиеновые каучуки Алюминий
Алюминий Phosphorus
Phosphorus Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Получение и применение спиртов
Получение и применение спиртов Растворы и растворители
Растворы и растворители Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Кислород, азот, водород и инертные газы. Раздел 3
Кислород, азот, водород и инертные газы. Раздел 3 Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей
Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей ВОДОРОД
ВОДОРОД Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5
Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5 Многоатомные спирты (10 класс)
Многоатомные спирты (10 класс) Хлор
Хлор Аминокислоты и белки
Аминокислоты и белки Строение атома
Строение атома Химия в повседневной жизни человека
Химия в повседневной жизни человека Дисперсні системи. Загальні властивості розчинів
Дисперсні системи. Загальні властивості розчинів Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Обмен липидов
Обмен липидов Свойства катализатора. Влияние массы катализатора на скорость реакции
Свойства катализатора. Влияние массы катализатора на скорость реакции Нефть и способы её переработки
Нефть и способы её переработки