Содержание
- 2. Химический элемент №22. Титан. Титан (Titanium),Ti,— химический элемент IV группы периодической системы элементов Д. И. Менделеева.
- 3. История открытия В 1791 году английский химик У. Грегор нашёл в песке из местечка Менакан (Англия,
- 4. Нахождение в природе Титан относится к числу наиболее распространённых в природе элементов, его содержание в земной
- 5. Промышленный способ добычи титана был разработан только в 40-х гг. XX века. Способы получения титана В
- 6. Титан обладает следующими физическими свойствами: Таблица – Основные физические свойства титана
- 7. Химические свойства Титан является очень активным металлом, но его оксидная пленка не даёт ему взаимодействовать при
- 8. Применение Титан и его сплавы отличает не только коррозионная стойкость, но и лёгкость, прочность. В связи
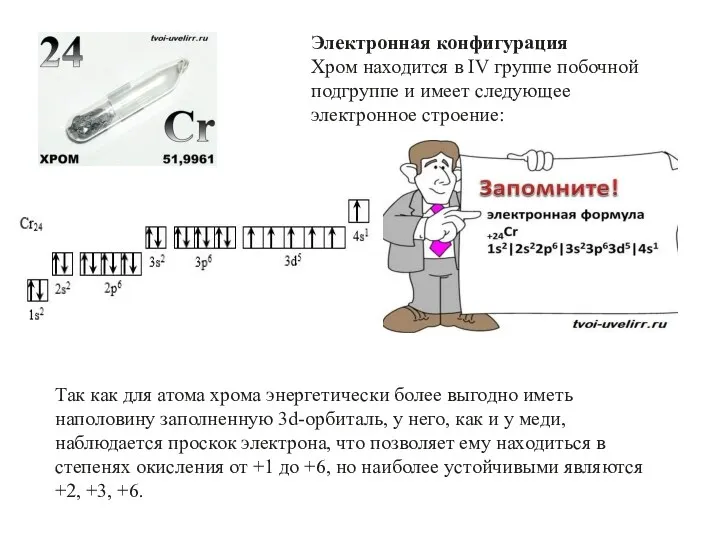
- 10. Электронная конфигурация Хром находится в IV группе побочной подгруппе и имеет следующее электронное строение: Так как
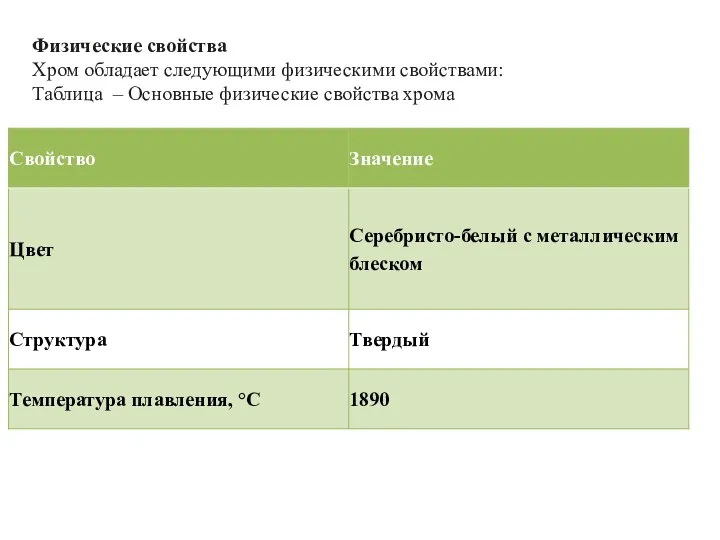
- 11. Физические свойства Хром обладает следующими физическими свойствами: Таблица – Основные физические свойства хрома
- 12. Нахождение в природе В природе большая часть хрома заключена в составе хромистого железняка Fe(CrO2)2. Иногда может
- 13. Химические свойства Как и титан , хром покрыт оксидной плёнкой, которую трудно растворить даже сильными кислотами.
- 14. Химические свойства хрома I. Взаимодействие с простыми веществами. 1. При обычных условиях хром реагирует только со
- 15. Применение Благодаря своей коррозионной стойкости, хром используют в качестве защитных покрытий (хромируют поверхности металлов и сплавов).
- 17. Скачать презентацию












 Ртуть и цинк
Ртуть и цинк Драгоценные камни
Драгоценные камни Соли, их классификация и свойства
Соли, их классификация и свойства Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Теория электролитической диссоциации
Теория электролитической диссоциации Химия и биологическая роль элементов VIIА-группы
Химия и биологическая роль элементов VIIА-группы Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы Составление уравнений химических реакций. Закон сохранения массы веществ
Составление уравнений химических реакций. Закон сохранения массы веществ Водород
Водород Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) Коррозия металлов
Коррозия металлов Строение, свойства и применение алкенов
Строение, свойства и применение алкенов Дистилляция в химической промышленности
Дистилляция в химической промышленности Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Кислород. Озон. Получение кислорода
Кислород. Озон. Получение кислорода Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар
Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар 20230802_stroenie_atoma_avtosohranennyy_2
20230802_stroenie_atoma_avtosohranennyy_2 Хімічні властивості алкенів
Хімічні властивості алкенів Биоразлагаемые ПАВ. Лекция 2
Биоразлагаемые ПАВ. Лекция 2 Принципы наноармирования волокнистых композитов
Принципы наноармирования волокнистых композитов Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Альдегиды и кетоны
Альдегиды и кетоны Искусственная и синтетическая резина
Искусственная и синтетическая резина Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Задачи на избыток-недостаток
Задачи на избыток-недостаток Синтетический каучук и его применение
Синтетический каучук и его применение