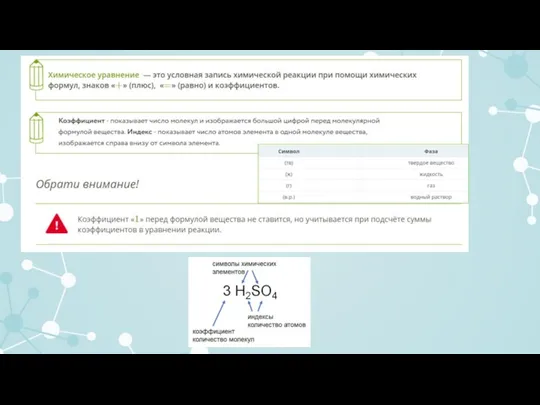
Составим уравнение химической реакции взаимодействия фосфора и кислорода
Алгоритм составления уравнения химической
реакции
В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию).
Помните! Молекулы большинства простых газообразных веществ двухатомны –
H2; N2; O2; F2; Cl2; Br2; I2.
Между реагентами ставим знак «+», а затем стрелку:
P + O2 →
В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии).
Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O2 → P2O5









 Основания. Получение и химические свойства
Основания. Получение и химические свойства Кислоты. Яблочная кислота
Кислоты. Яблочная кислота Соляная кислота. Хлориды
Соляная кислота. Хлориды Хімічний елемент Літій
Хімічний елемент Літій Кислоты
Кислоты Группа редкоземельных элементов
Группа редкоземельных элементов Что такое химия. Техника безопасности. Интересные факты (урок 1)
Что такое химия. Техника безопасности. Интересные факты (урок 1) Показатели химической обстановки при авариях на химически опасных объектах
Показатели химической обстановки при авариях на химически опасных объектах Спирты. Состав, строение спиртов
Спирты. Состав, строение спиртов Властивості вуглеводів. Лабораторна робота 3
Властивості вуглеводів. Лабораторна робота 3 Определение качественного состава минеральных вод
Определение качественного состава минеральных вод Химия элементов. Общая характеристика элементов
Химия элементов. Общая характеристика элементов Области применения лития
Области применения лития Каучук, резина и другие
Каучук, резина и другие Қатты күйдегі препараттар
Қатты күйдегі препараттар Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Криминалистическое исследование нефтепродуктов, горючесмазочных материалов, спиртосодержащих жидкостей,
Криминалистическое исследование нефтепродуктов, горючесмазочных материалов, спиртосодержащих жидкостей, Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Рідкі кристали
Рідкі кристали Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Stoffe bestehen aus kleinsten teilchen
Stoffe bestehen aus kleinsten teilchen Atmospheric chemistry
Atmospheric chemistry Свинец
Свинец Вуглецьвмісна сировина для одержання вуглецевих сорбентів
Вуглецьвмісна сировина для одержання вуглецевих сорбентів Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Относительные атомные и молекулярные массы
Относительные атомные и молекулярные массы