Содержание
- 2. 1 21.09.2016 Теория химического строения органических соединений Урок 9 класса. Реакции ионного обмена
- 3. 2 22.09.2016 Принцип Ле Шателье Вспомним принцип Ле Шателье: Если на систему, находящуюся в равновесии, воздействовать
- 4. 3 22.09.2016 Смещение равновесия H2O H+ + OH- H2SO4 2H+ + SO42- H2O H+ + OH-
- 5. 4 22.09.2016 Задачи Найдите водородный показатель раствора азотной кислоты (HNO3), если его молярная концентрация равна 0,178
- 6. Смещение равновесия Найдите водородный показатель раствора азотной кислоты (HNO3), если его молярная концентрация равна 0,178 моль/л.
- 7. 5 22.09.2016 pH Когда [H+] > [OH−] говорят, что раствор является кислотным, а при [OH−] >
- 8. 6 22.09.2016 Определение кислотности раствора
- 9. 7 22.09.2016 Определение галогенид-ионов Галогенид-ионы определяются при взаимодействиями с солями серебра: AgNO3 + KCl = KNO3
- 10. 8 22.09.2016 Определение галогенид-ионов Качественная реакция на соли меди: Cu2+ +2OH— → Cu(OH)2↓ Качественные реакции на
- 11. 9 22.09.2016 Барий и сульфат-ион Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария;
- 12. 10 22.09.2016 Алюминий, цинк, фосфат-ион Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓ избыток
- 14. Скачать презентацию
 Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Аномальные свойства воды
Аномальные свойства воды Нітрати – токсичні речовини
Нітрати – токсичні речовини Фосфор красный, белый и черный
Фосфор красный, белый и черный Серебро. Нахождение в природе
Серебро. Нахождение в природе Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ
Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ Коррозия металлов
Коррозия металлов Органическая химия
Органическая химия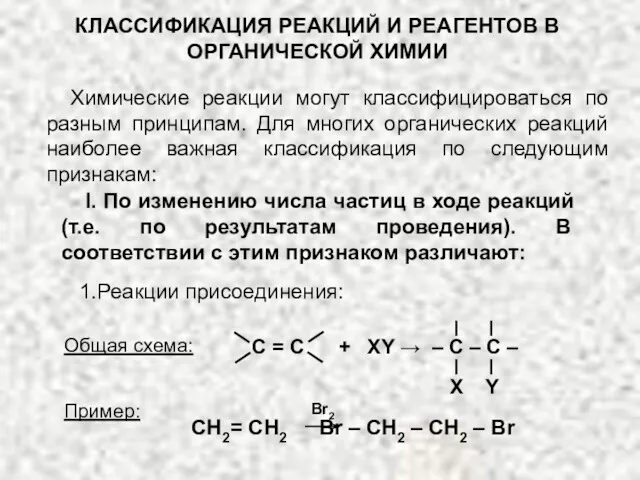 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Полимеры. Мономер
Полимеры. Мономер Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар
Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар Водородный показатель
Водородный показатель Качественные реакции
Качественные реакции Алифатические углеводороды: алканы, алкены, алкины
Алифатические углеводороды: алканы, алкены, алкины Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Энергетическое топливо и его классификация
Энергетическое топливо и его классификация Фуллерен С60 и его аналоги
Фуллерен С60 и его аналоги Роль воды в химических реакциях
Роль воды в химических реакциях Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура
Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура Рафинирование металлических расплавов
Рафинирование металлических расплавов Определение содержания общего белка и казеина в молоке формольным методом
Определение содержания общего белка и казеина в молоке формольным методом Химический элемент водород
Химический элемент водород Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Галогены. История открытия галогенов
Галогены. История открытия галогенов Волокна та їх властивості
Волокна та їх властивості Химические реакции. Классификация. Повторение
Химические реакции. Классификация. Повторение Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Непредельные углеводороды. Этиленовые углеводороды (алкены)
Непредельные углеводороды. Этиленовые углеводороды (алкены)