Содержание
- 2. Один опыт я ставлю выше, чем тысячу мнений, рожденных только воображением. М.В.Ломоносов.
- 3. Цели: 1. обучающая -Исследовать физические и химические свойства кислот, -Познакомиться с электрохимическим рядом напряжения металлов, показать
- 4. Цель урока: -Исследовать физические и химические свойства кислот, -Познакомиться с электрохимическим рядом напряжения металлов, показать принцип
- 5. Задачи: Закрепить умение наблюдать за химическими реакциями, описывать их и делать выводы. Продолжить формирование умений и
- 6. Актуализация Дайте определение классу кислот. Исходя из определения, выведите общую формулу кислот. Кислот достаточно много, а
- 7. Что нас объединяет?
- 8. Выберите и назовите формулы кислот 1) HCI, CO2 , NaOH , H2SO4 2) NaCI , H3PO4
- 9. Физические свойства жидкости (кроме кремниевой кислоты) без цвета без запаха кислые на вкус
- 10. Химические свойства «Кислоты – едкие вещества, вызывающие сильнейшие ожоги, разрушают органические вещества» - данное высказывание можно
- 11. Техника безопасности от строгой химички. Ты в хим. кабинет пришел Так запомни кроха Безопасность хорошо, Быть
- 12. Действие индикаторов H2SO4 + лакмус ? красный + ф.ф. ? бесцветный + м.о. ? красный
- 13. Электрохимический ряд напряжений
- 14. Взаимодействие с металлами ( до Н !) H2SO4 + Zn ? ZnSO4 + H2 ? H2SO4
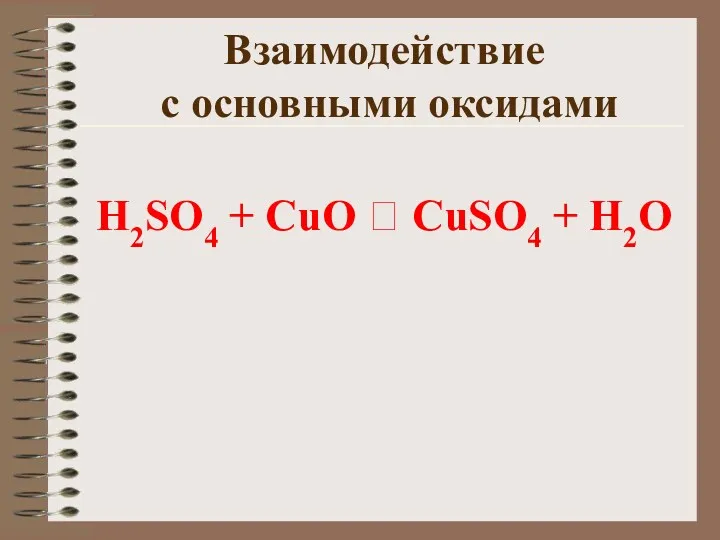
- 15. Взаимодействие с основными оксидами H2SO4 + CuO ? CuSO4 + H2O
- 16. Взаимодействие с растворимыми основаниями (щелочами) H2SO4 + 2NaOH ? Na2SO4 + 2H2O
- 17. Взаимодействие с нерастворимыми основаниями H2SO4 + Cu(OH)2? ? CuSO4 + 2H2О синий
- 18. Взаимодействие с солями H2SO4 + ВаCL2 ? BaSO4? + 2 HCL белый
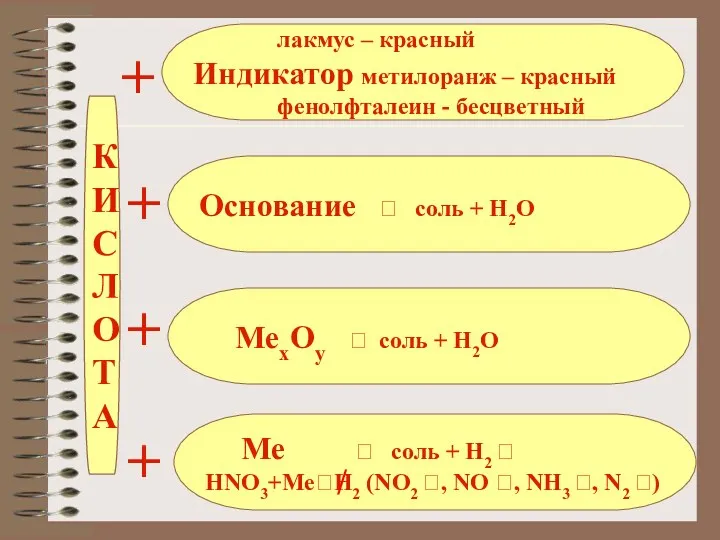
- 19. К И С Л О Т А Основание ? соль + Н2О лакмус – красный Индикатор
- 20. Ответы на тестирование 1. В 2. В 3. В 4. В 5. -- 6. А 7.
- 21. 5. Допишите возможные уравнения реакций: 6HCl + 2Al = 2AlCl3 + 3H2 H2SO4 + Hg =
- 22. дополнительное задание С какими из перечисленных веществ вступает в реакцию хлороводородная (соляная) кислота: Na2О, Сu, SO3,
- 23. 1. Определяем принадлежность заданных в условий веществ к соответствующим классам и тут же проверяем, реагируют ли
- 24. Интересные сведения о кислотах
- 25. Домашнее задание Пар. 45, решить стр.155 №3,4,5
- 27. Скачать презентацию






















 Галогены
Галогены Коррозия металлов
Коррозия металлов Заключительный урок в 8 классе Тест по химии.
Заключительный урок в 8 классе Тест по химии. Технология производства сложных полиэфиров
Технология производства сложных полиэфиров Вред Coca-Cola на организм человека
Вред Coca-Cola на организм человека Оксиды и гидроксиды металлов. 11 класс
Оксиды и гидроксиды металлов. 11 класс Непредельные углеводороды
Непредельные углеводороды Аммиак
Аммиак Мыло
Мыло Олово и свинец
Олово и свинец Судың диссоциациялануы. Сутектік көрсеткіш. Тұздар гидролизі
Судың диссоциациялануы. Сутектік көрсеткіш. Тұздар гидролизі Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления
Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Коррозия металлов
Коррозия металлов Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Кислородные соединения азота
Кислородные соединения азота Карбоновые кислоты
Карбоновые кислоты Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Кислоты и основания. (Лекция 16)
Кислоты и основания. (Лекция 16) Stirring in liquid media
Stirring in liquid media Химия в быту
Химия в быту Ископаемые углеводороды
Ископаемые углеводороды NaHSO4. Гидросульфат натрия
NaHSO4. Гидросульфат натрия Современные тенденции развития химии
Современные тенденции развития химии Иондық байланыс
Иондық байланыс Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне ЕГЭ по химии. Анализ результатов решения (часть 2)
ЕГЭ по химии. Анализ результатов решения (часть 2) Органические и неорганические кислоты
Органические и неорганические кислоты