Содержание
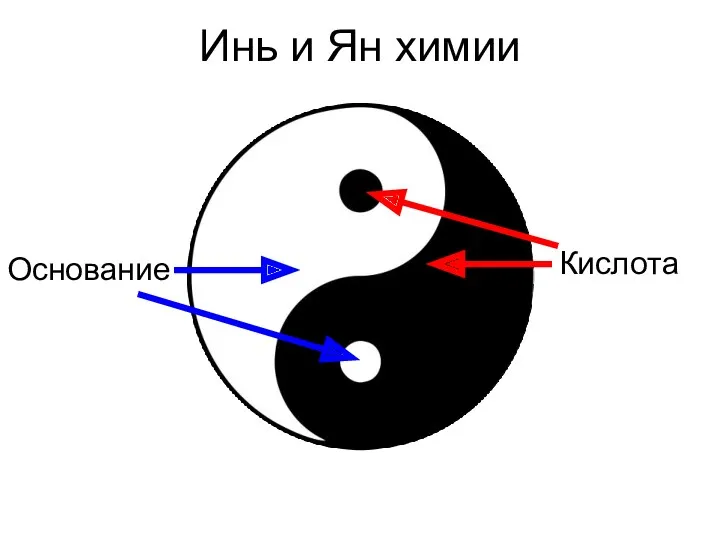
- 2. Инь и Ян химии Кислота Основание
- 3. Теория электролитической диссоциации: недостатки Применимо только к водным растворам, исключая: а) реакции в газовой и твердой
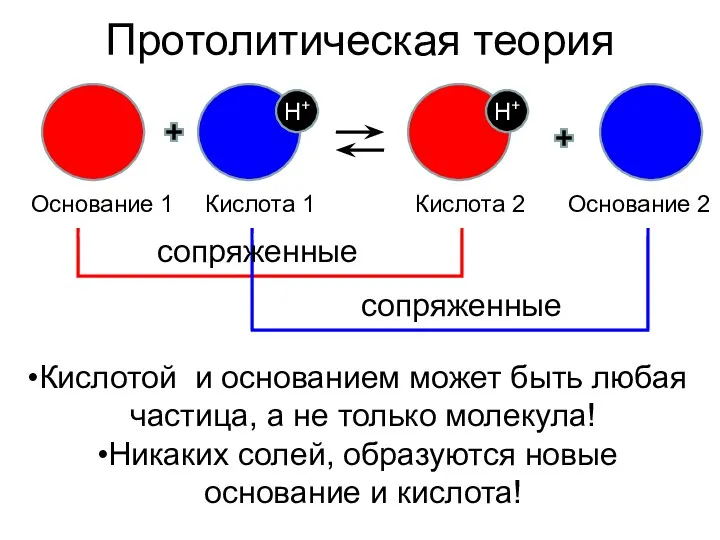
- 4. Протолитическая теория (1923) Кислота – донор протона, основание – акцептор протона. У каждой кислоты есть сопряженное
- 5. Протолитическая теория H+ H+ Основание 1 Кислота 1 Кислота 2 Основание 2 сопряженные сопряженные Кислотой и
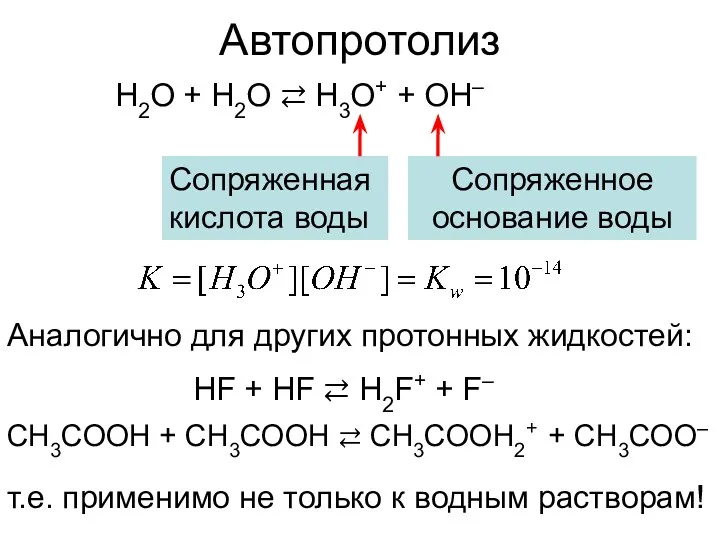
- 6. Автопротолиз H2O + H2O ⇄ H3O+ + OH– Аналогично для других протонных жидкостей: HF + HF
- 7. Константы ионизации для сопряженных кислот и оснований HF + H2O ⇄ H3O+ + F– F– +
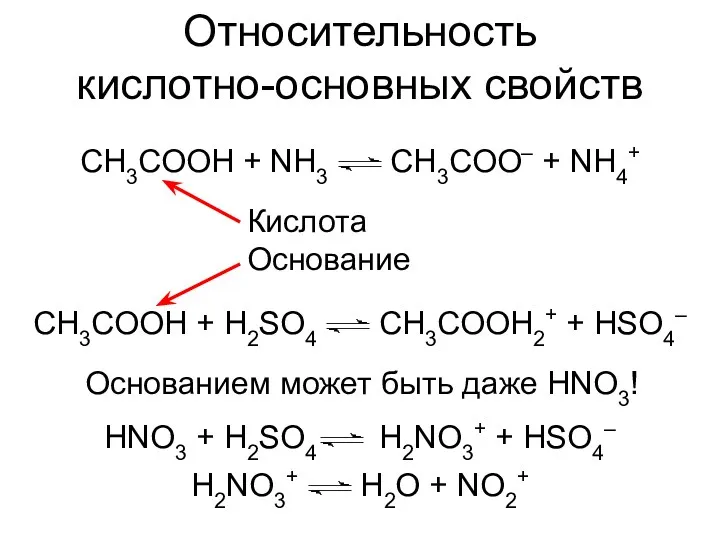
- 8. Относительность кислотно-основных свойств CH3COOH + H2SO4 CH3COOH2+ + HSO4– HNO3 + H2SO4 H2NO3+ + HSO4– Кислота
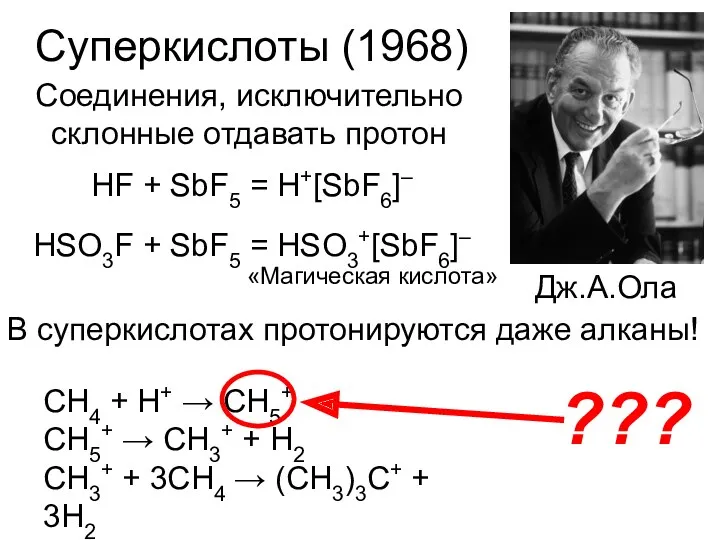
- 9. Суперкислоты (1968) Дж.А.Ола Соединения, исключительно склонные отдавать протон HF + SbF5 = H+[SbF6]– HSO3F + SbF5
- 10. Ограничения протолитической теории Неприменима к реакциям без растворителя; Неприменима к полностью апротонным (не содержащим катионов водорода
- 11. Что за вещество? Тяжелая жидкость с едким, раздражающим запахом; «Дымит» на воздухе; Бурно реагирует со щелочами
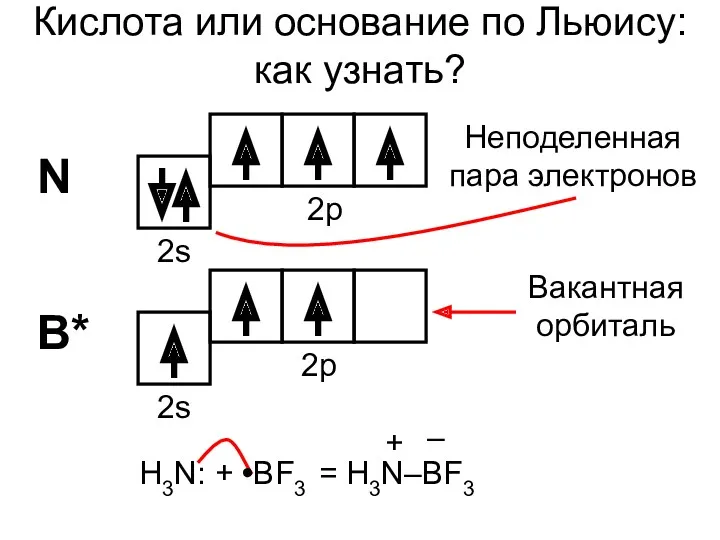
- 12. Электронная теория (1923) Кислоты – акцепторы пары электронов (имеют вакантные орбитали) Основания – доноры пары электронов
- 13. Кислота или основание по Льюису: как узнать? N B* 2s 2p 2s 2p Неподеленная пара электронов
- 14. Применение теории Льюиса Кислоты Основания AlCl3 + Cl– = [AlCl4]– Zn2+ + 4H2O = [Zn(H2O)4]2+ Химия
- 15. Ограничения теории Льюиса Не работает для некоторых протонных кислот: HF + NH3 = NH4F – но
- 16. Теория реакций в расплаве Лукса – Флуда Применяется для реакций между кислородсодержащими соединениями Хорошо описывает взаимодействия
- 17. Теория «ониевых солей» Ганча Главный признак кислотно-основной реакции – солеобразование; То, что превращается в анион –
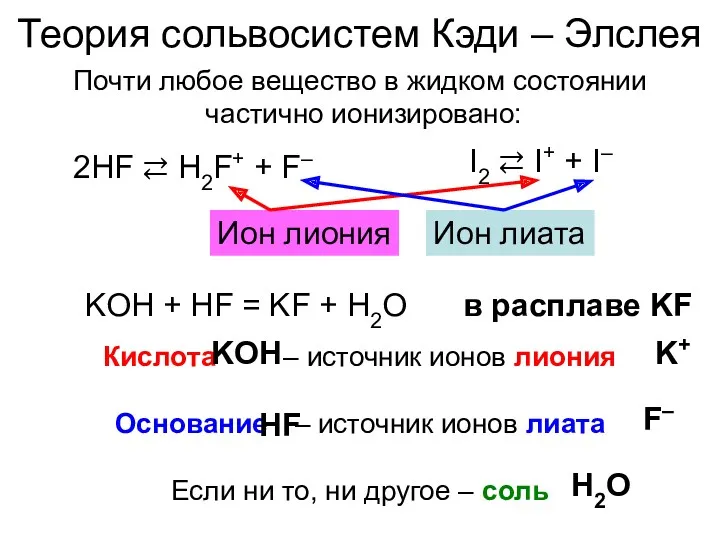
- 18. Теория сольвосистем Кэди – Элслея Почти любое вещество в жидком состоянии частично ионизировано: 2HF ⇄ H2F+
- 19. Обобщенная теория кислот и оснований Усановича (1938 г.) М.И.Усанович (1896–1981) «Кислоты и основания – это не
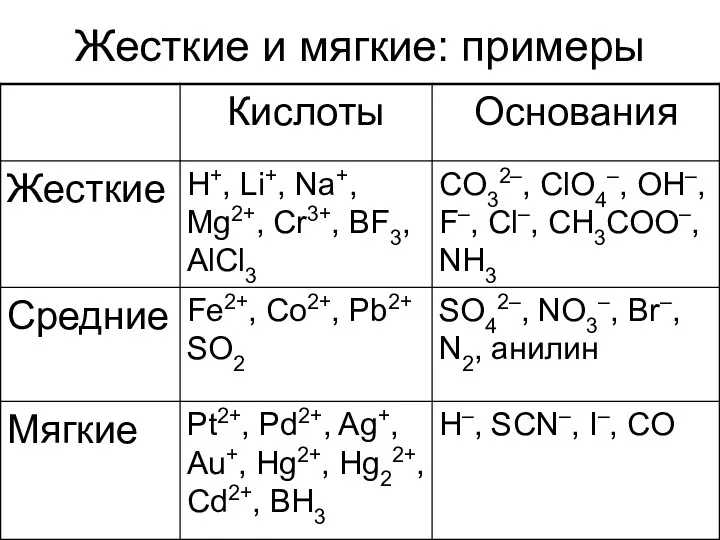
- 20. Теория ЖМКО: жестких и мягких кислот и оснований Пирсона (1963) Маленький радиус (объем) Высокая степень окисления
- 21. Жесткие и мягкие: примеры
- 22. Теории кислотно-основного взаимодействия
- 24. Скачать презентацию






![Применение теории Льюиса Кислоты Основания AlCl3 + Cl– = [AlCl4]–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361201/slide-13.jpg)






 Знакомство с лабораторным оборудованием
Знакомство с лабораторным оборудованием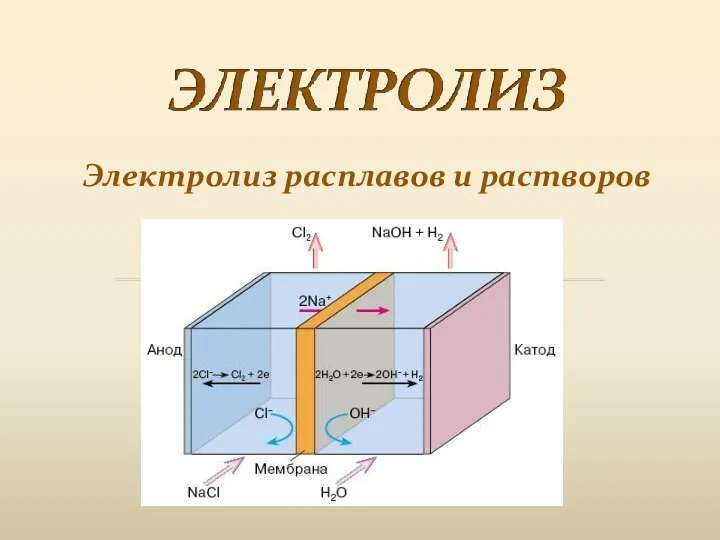 Электролиз расплавов и растворов
Электролиз расплавов и растворов Вред Coca-Cola на организм человека
Вред Coca-Cola на организм человека Основные понятия. Химический язык
Основные понятия. Химический язык Типы химических реакций
Типы химических реакций Кислоты
Кислоты Соляные породы
Соляные породы Химическая промышленность
Химическая промышленность Видалення забруднень органічного походження з поверхні тканини
Видалення забруднень органічного походження з поверхні тканини 20230410_prilozhenie_1
20230410_prilozhenie_1 Газообразные вещества
Газообразные вещества Нефть и способы ее переработки (10 класс)
Нефть и способы ее переработки (10 класс) Органическая химия. Этапы развития органической химии
Органическая химия. Этапы развития органической химии Виды присадок к моторным топливам (керосин)
Виды присадок к моторным топливам (керосин)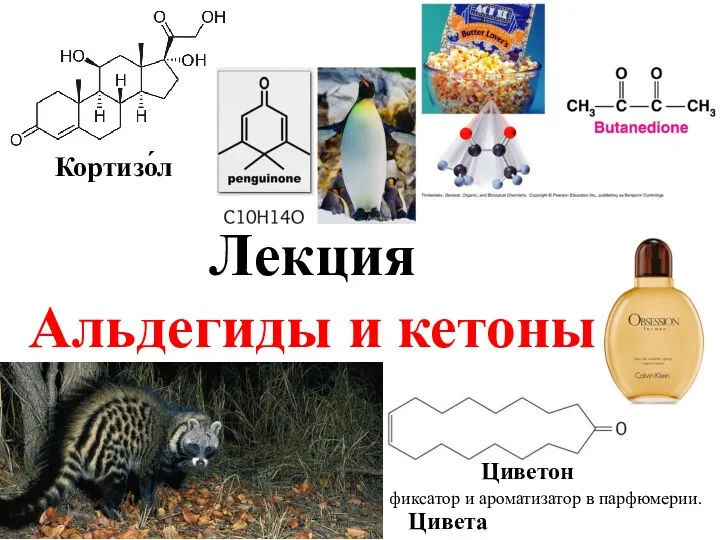 Альдегиды и кетоны. Циветон
Альдегиды и кетоны. Циветон Ионоселективные электроды
Ионоселективные электроды Electron Structure
Electron Structure Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Элементы второй группы главной подгруппы
Элементы второй группы главной подгруппы Типы химических реакций
Типы химических реакций Электродные потенциалы
Электродные потенциалы Гідроліз солей
Гідроліз солей Хромопротеиды: биологическая роль. Синтез и распад гема. Метаболизм билирубина
Хромопротеиды: биологическая роль. Синтез и распад гема. Метаболизм билирубина Химия вокруг нас. Викторина
Химия вокруг нас. Викторина Основные законы химии. (Лекция 1)
Основные законы химии. (Лекция 1) Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Запобігання виникнення горіння засобами, що розбавлюють та інгібують
Запобігання виникнення горіння засобами, що розбавлюють та інгібують Функциональные производные с простой связью C-“Э”. Часть 2. Галогенпроизводные
Функциональные производные с простой связью C-“Э”. Часть 2. Галогенпроизводные