Содержание
- 2. УМК «ХИМИЯ» Тема лекции: Электродные потенциалы Лектор – Иванов М.Г.
- 3. Цель лекции: изложение основных понятий электродных потенциалов на границе металл- раствор электролита в рамках современной химической
- 4. СОДЕРЖАНИЕ Основные понятия Носители заряда Связь электродного потенциала и энергии Гиббса Водородный электрод Уравнение Нернста Потенциалы
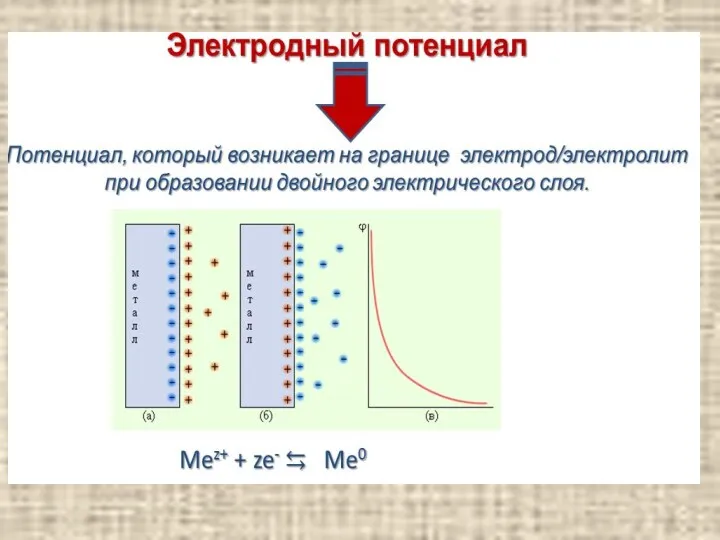
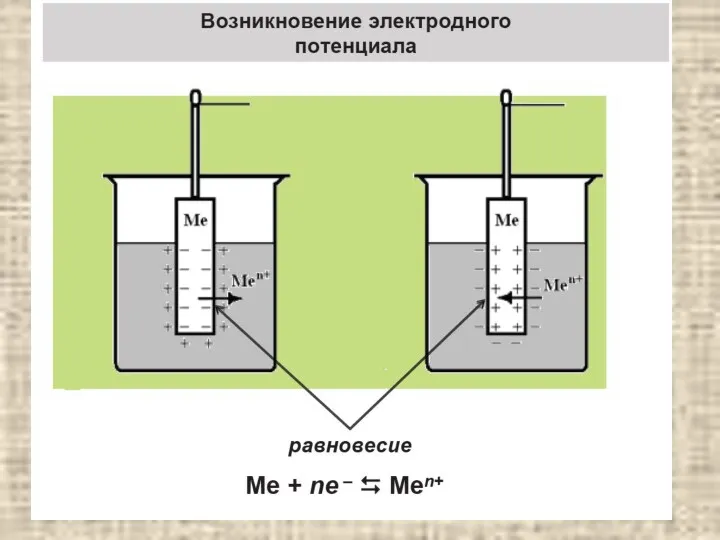
- 5. Основные понятия содержание По типу носителей заряда проводники электрического тока делят на две группы: в проводниках
- 10. содержание Основные понятия ΔGо = – ЕоnF ΔGо = – RT•lnK Электродный потенциал служит мерой изменения
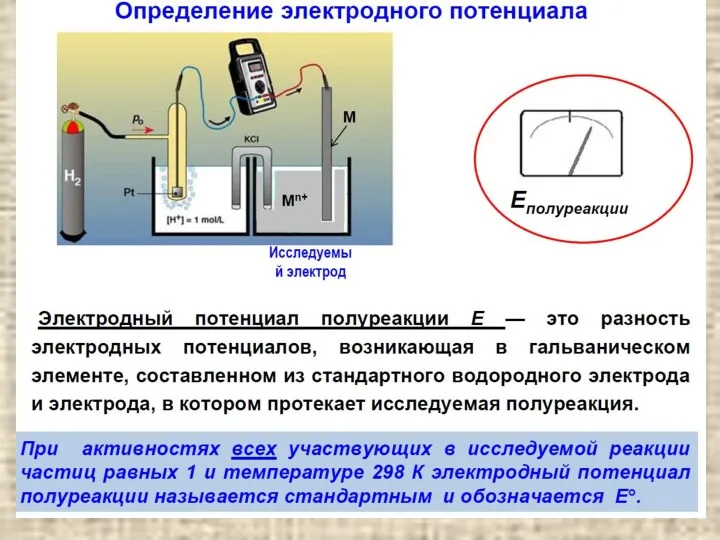
- 14. содержание Основные понятия Me/[Me(H2O)m]n+⎥⎥ (H2, H2SO4)/Pt За величину электродного потенциала данного электрода в водородной шкале принимают
- 16. содержание Уравнение Нернста R = 8,314 Дж/(моль К) – универсальная газовая постоянная; F = 96500 Кл/моль
- 17. содержание Уравнение Нернста для водородного электрода: для ионно-металлического электрода:
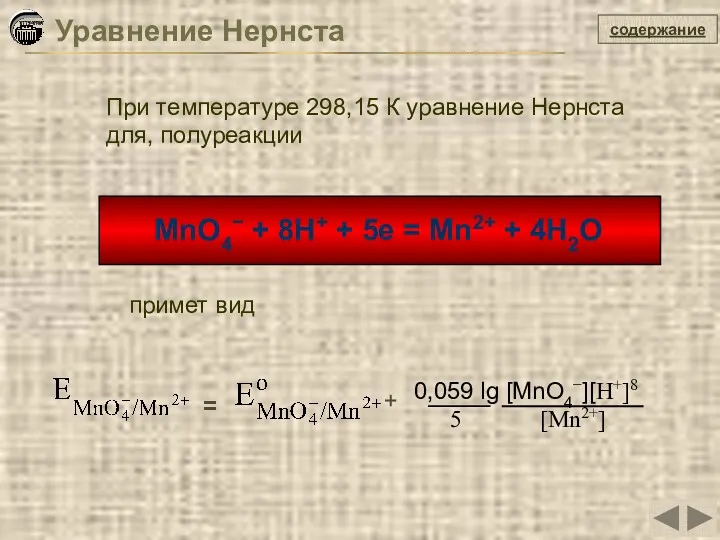
- 18. содержание MnO4− + 8H+ + 5e = Mn2+ + 4H2O = 0,059 lg [MnO4−][H+]8 5 [Mn2+]
- 19. содержание Для реакций O2 + 4e + 4H+ = 2H2O; Уравнение Нернста
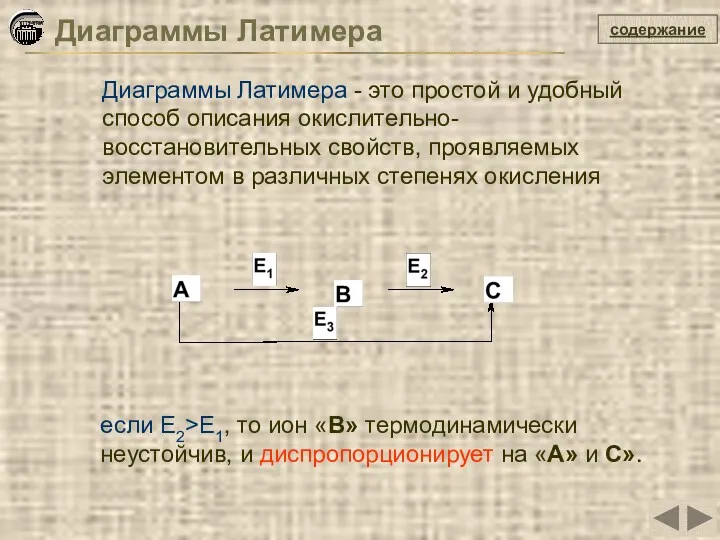
- 20. Диаграммы Латимера содержание если Е2>Е1, то ион «В» термодинамически неустойчив, и диспропорционирует на «А» и С».
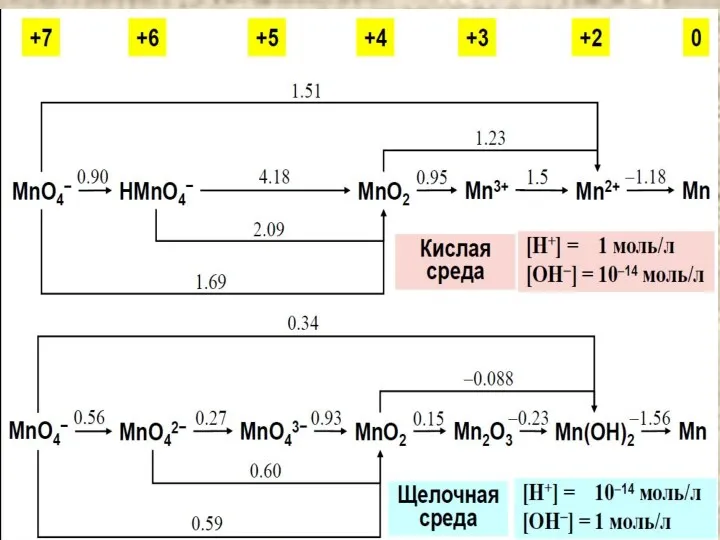
- 21. содержание pH = 14 pH = 0 Диаграммы Латимера
- 23. содержание Диаграммы Пурбе 25°C: [Cu] = 10-4 M.
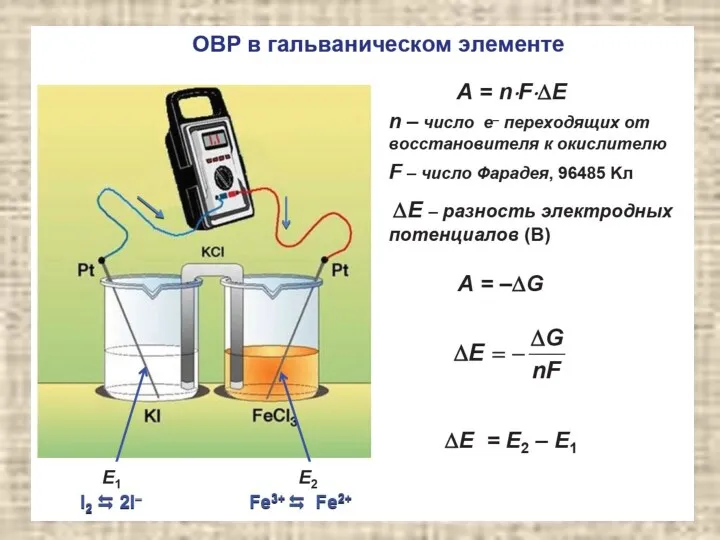
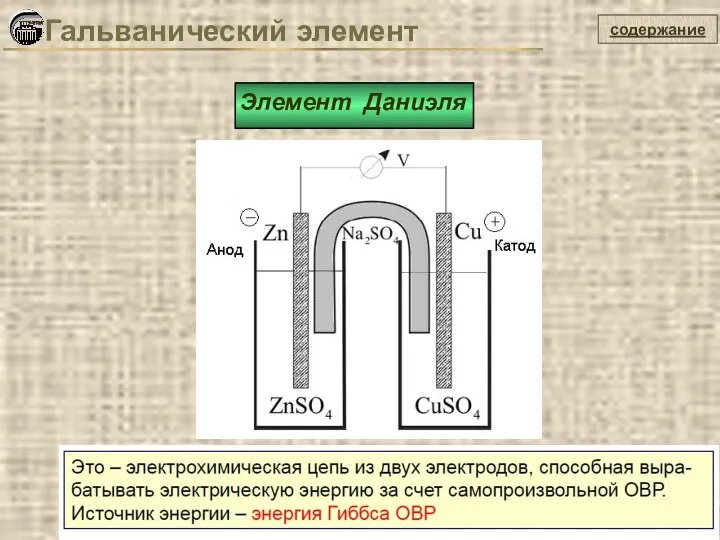
- 24. содержание Гальванический элемент Элемент Даниэля
- 25. содержание Zn / ZnSO4 ⎥⎥ CuSO4 / Cu Гальванический элемент Элемент Даниэля Cu2+ + 2e =
- 26. содержание Zn / ZnSO4 ⎥⎥ KMnO4, H2SO4, MnSO4, /С 2 MnO4− + 5e +8H+ = Mn2+
- 39. Скачать презентацию








![содержание Основные понятия Me/[Me(H2O)m]n+⎥⎥ (H2, H2SO4)/Pt За величину электродного потенциала](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/234315/slide-13.jpg)





![содержание Диаграммы Пурбе 25°C: [Cu] = 10-4 M.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/234315/slide-22.jpg)


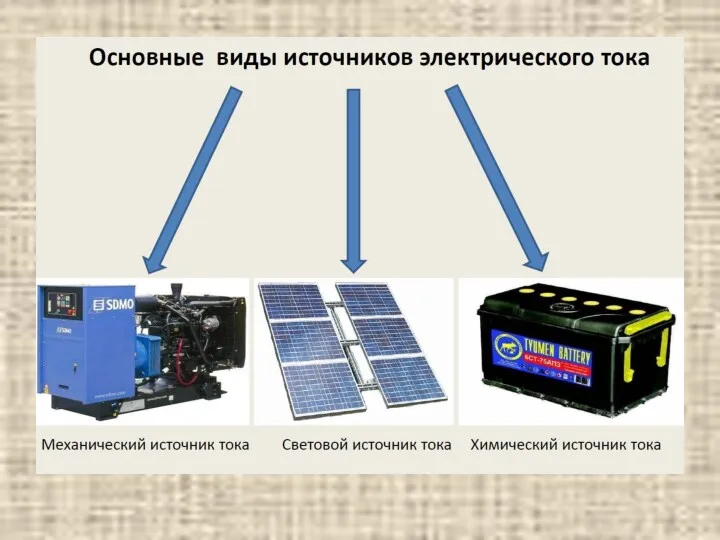





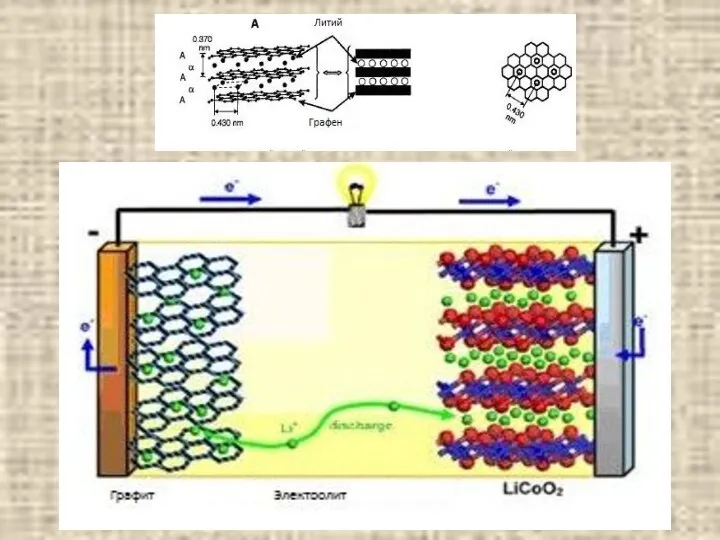
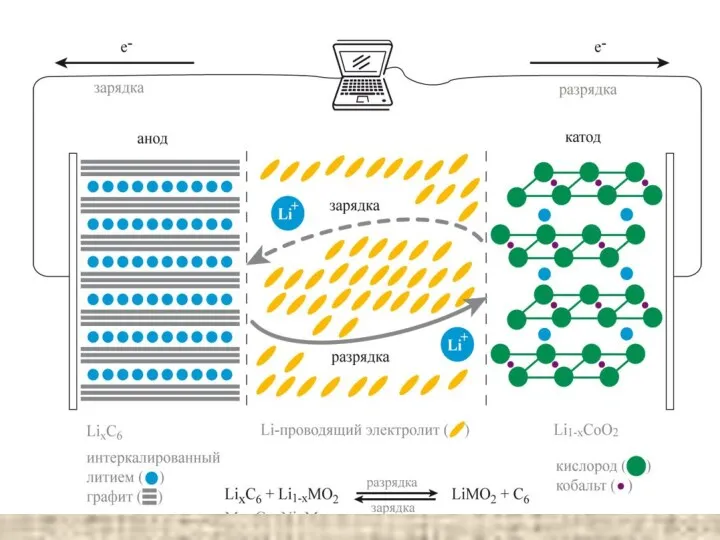


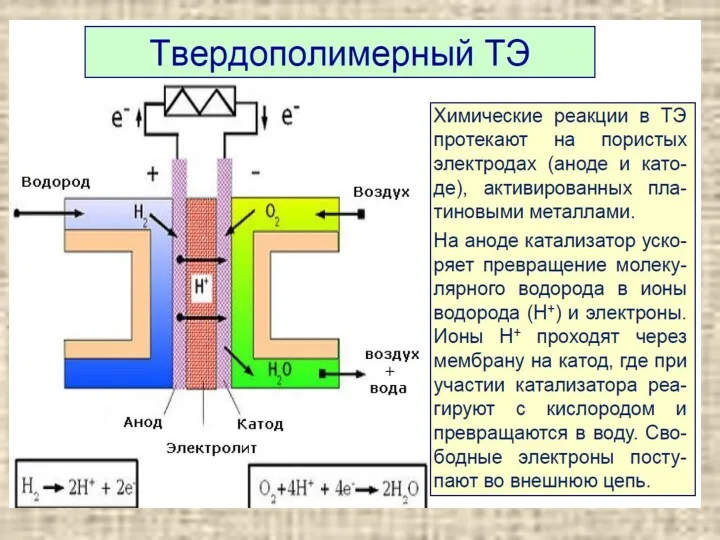
 Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Полистирол өндірісі
Полистирол өндірісі Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Ионная связь
Ионная связь Создание слоев пористого кремния на p-Si
Создание слоев пористого кремния на p-Si Свойства идеального газа на примере воздуха
Свойства идеального газа на примере воздуха Основные виды химических связей
Основные виды химических связей Ионные уравнения
Ионные уравнения альдегиды, свойства, получение
альдегиды, свойства, получение Химический элемент радий
Химический элемент радий Подготовка к итоговой контрольной работе. (9 класс)
Подготовка к итоговой контрольной работе. (9 класс) Предмет органической химии. Теория химического строения органических веществ
Предмет органической химии. Теория химического строения органических веществ Аккумуляторы и их устройство
Аккумуляторы и их устройство А.М. Бутлеровтың химиялык кұрылыс теориясы
А.М. Бутлеровтың химиялык кұрылыс теориясы Степень окисления элементов
Степень окисления элементов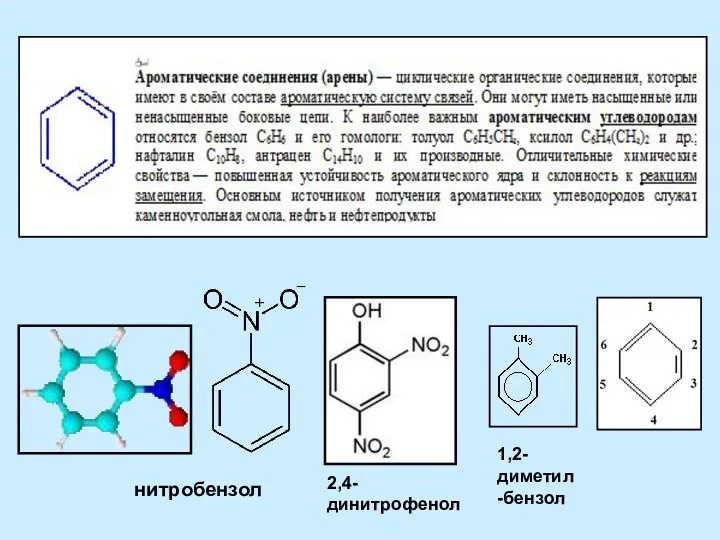 Ароматические соединения (арены)
Ароматические соединения (арены) Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Нафта. Класифікація нафти
Нафта. Класифікація нафти Кислоты. Яблочная кислота
Кислоты. Яблочная кислота Ионы. Проверочная работа
Ионы. Проверочная работа Соли. Классификация и свойства солей
Соли. Классификация и свойства солей Предельные углеводороды и их производные
Предельные углеводороды и их производные Нефть. Химический состав нефти
Нефть. Химический состав нефти Химическая связь
Химическая связь Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Inert metals
Inert metals Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів
Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів Горные породы
Горные породы