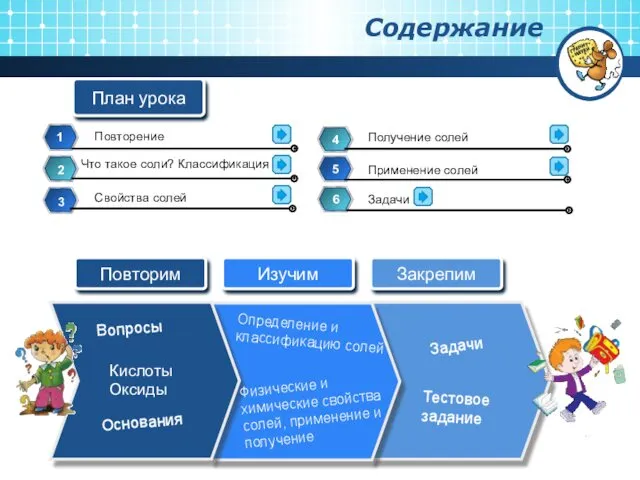
Содержание
- 2. Вопросы Кислоты Оксиды Физические и химические свойства солей, применение и получение Основания Определение и классификацию солей
- 3. Повторим гидроксид кальция щелочи голубую двухосновная, кислородсодержащая, сильная кислота содержание
- 4. Соли – сложные вещества, образованные атомами металлов и кислотного остатка Что такое соли? Классификация солей Na3PO4
- 5. Свойства солей Физические свойства Соли - твердые вещества разного цвета. Растворимость их различна. Некоторые хорошо растворимы,
- 6. Химические свойства Соли реагируют с металлами ( исключения активные металлы: Li, Na, K, Ca, Ba -
- 7. Соли реагируют с некоторыми кислотными оксидами: CaCO3 + SiO2 = CaSiO3 + CO2 Соли реагируют с
- 8. Получение солей Взаимодействие металлов и неметаллов: 2Fe + 3Cl2 = 2FeCl3 Взаимодействие кислотных оксидов с основными
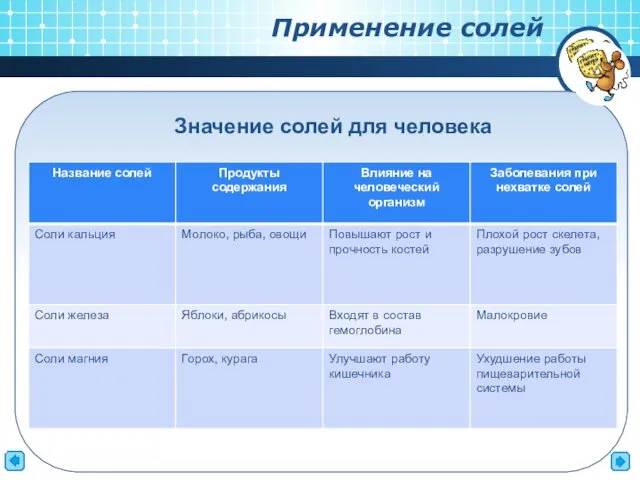
- 9. Применение солей Значение солей для человека
- 10. mm =m = 18,8 гm = 18,8 г nm = 18,8 г n m = 18,8
- 11. Дано: Решение: n (CuO) = 0,1 моль CuO + 2HNO3 = Cu(NO3)2 + H2O HNO3 n
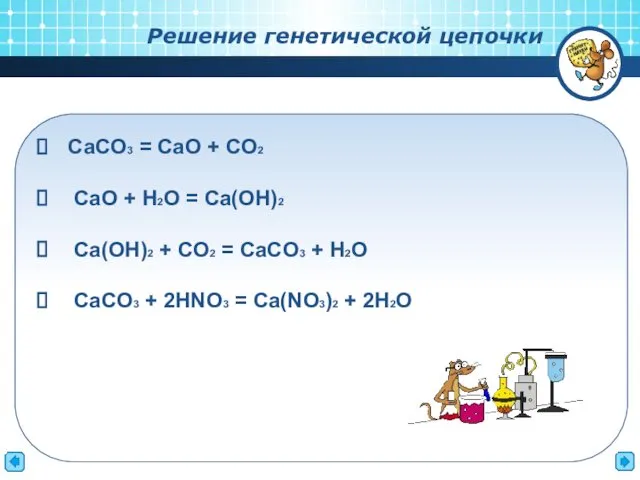
- 12. СaCO3 = CaO + CO2 CaO + H2O = Ca(OH)2 Ca(OH)2 + CO2 = CaCO3 +
- 14. Скачать презентацию








 Азот в нашей жизни
Азот в нашей жизни Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Получение ткани
Получение ткани Органические и неорганические кислоты
Органические и неорганические кислоты Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Предмет и задачи физической химии
Предмет и задачи физической химии Химические волокна. Полиэфирные волокна. Лавсан
Химические волокна. Полиэфирные волокна. Лавсан Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Углекислый газ, угольная кислота и её соли
Углекислый газ, угольная кислота и её соли Нефелометрический анализ
Нефелометрический анализ Соли аммония
Соли аммония Природный газ
Природный газ
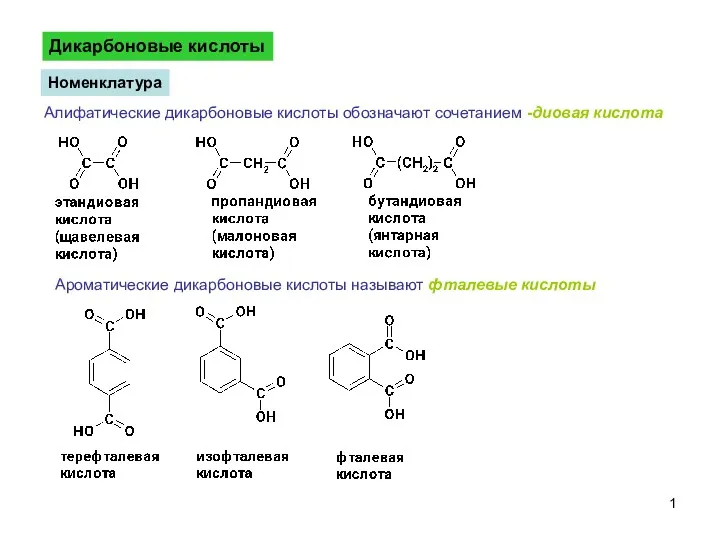 ДикарбоновыеКислоты-1
ДикарбоновыеКислоты-1 Металлы
Металлы Главная подгруппа IV группы
Главная подгруппа IV группы Свойства воды
Свойства воды Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Геохимия изотопов стабильных элементов
Геохимия изотопов стабильных элементов Физические свойства минералов
Физические свойства минералов Сложные эфиры. Жиры. Мыло
Сложные эфиры. Жиры. Мыло Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю
Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Неорганическая химия
Неорганическая химия Взрывчатые вещества, их история и применение
Взрывчатые вещества, их история и применение Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару
Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару