Содержание
- 2. План . Азотистый баланс. Биологическая ценность белка. Незаменимые аминокислоты.
- 3. Азотистый баланс Это разница между количеством азота, поступающего с пищей, и количеством выделяемого азота. Азотистый баланс
- 4. Белки. Белки – это азотсодержащие полимерные соединения, мономерами которых являются аминокислоты. Все белки принято делить на
- 5. Белки- жизненно необходимые вещества, относятся к основным пищевым вещества (макронутриентам). Биологическая активность других пищевых веществ проявляется
- 6. Суточная потребность в белке За сутки в организме взрослого человека распадается и вновь синтезируется до 400
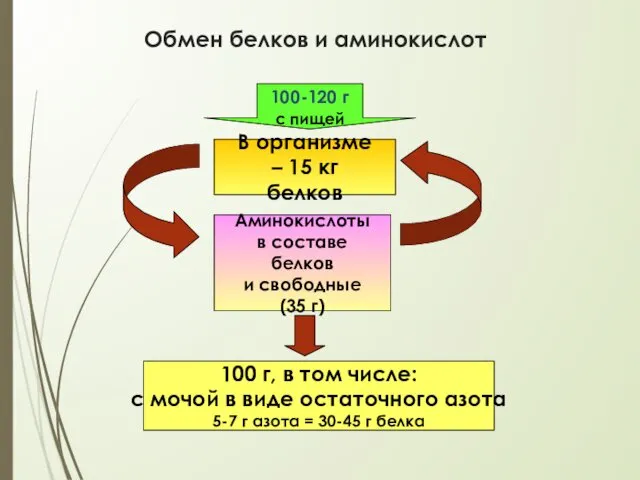
- 7. Обмен белков и аминокислот
- 8. Биологическая ценность белков определяется Аминокислотным составом Соотношением заменимых и незаменимых аминокислот: 6:1 Степенью усвоения т.е. как
- 9. Переваривание белков в ЖКТ В желудочном соке – пепсиноген→пепсин: 1-е молекулы медленно под действием HCl остальные
- 10. Незаменимые аминокислоты. Основными составными частями и структурными элементами белковой молекулы являются аминокислоты. Поступив с пищей, белки
- 11. Каждая аминокислота в организме имеет свое значение. Триптофан необходим для роста организма, поддержания азотистого равновесия, образования
- 12. Транспорт аминокислот Активный, Na-зависимый (Симпорт) Транспортеры (специфические переносчики): Нейтральных, с короткими радикалами – АЛА, СЕР, ТРЕ
- 13. Нарушение транспорта аминокислот Болезнь Хартнупа – дефект переносчика нейтральных аминокислот Иминоглицинурия – ПРО, оксипролин, ГЛИ Цистинурия
- 14. Обмен аминокислот Пути поступления аминокислот: а) транспорт из внеклеточной жидкости (при всасывании пищевых аминокислот); б) синтез
- 15. Толстый кишечник Брожение, гниение – результат действия кишечных бактерий: образуются газы СН4, СО2, Н2S, уксусная, молочная,
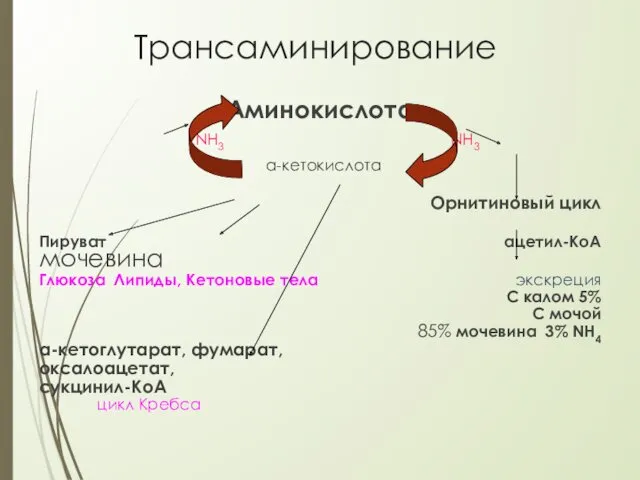
- 16. Трансаминирование –перенос аминогруппы с аминокислоты на α-кетокислоту. При этом количество аминокислот не меняется, т.к. образуются новая
- 17. Трансаминирование Аминокислота NH3 NH3 α-кетокислота Орнитиновый цикл Пируват ацетил-КоА мочевина Глюкоза Липиды, Кетоновые тела экскреция С
- 18. Дезаминирование - отщепление аминогруппы с образованием аммиака Существует четыре типа реакций: 1. Восстановительное дезаминирование ( +2H+)
- 19. Основные источники NH3 Аминокислоты, биогенные амины, нуклеотиды NH3 транспортируется из тканей в печень в виде 3
- 20. Механизм токсического действия аммиака NH3 легко проникает через мембраны в клетки В митохондриях – гипоэнергетическое состояние,
- 21. В обезвреживании NH3 – центральная роль принадлежит ГЛУ Основной реакцией обезвреживания NH3 в мышцах, мозге и
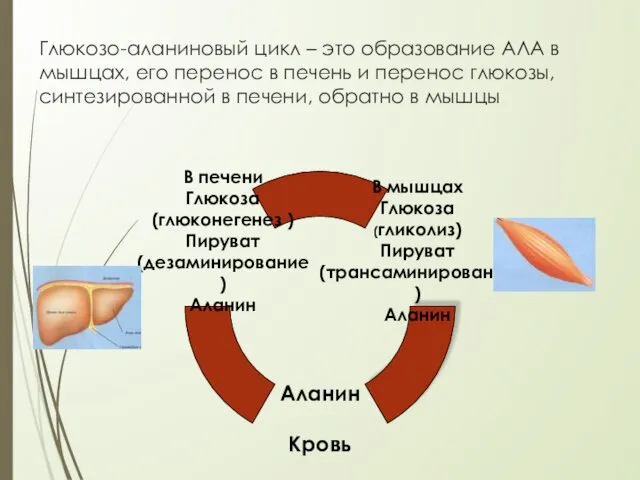
- 22. Глюкозо-аланиновый цикл – это образование АЛА в мышцах, его перенос в печень и перенос глюкозы, синтезированной
- 23. Основной путь обезвреживания NH3 в ЦНС – синтез глутамина под действием глутаминсинтазы Источники NH3 : АМФ,
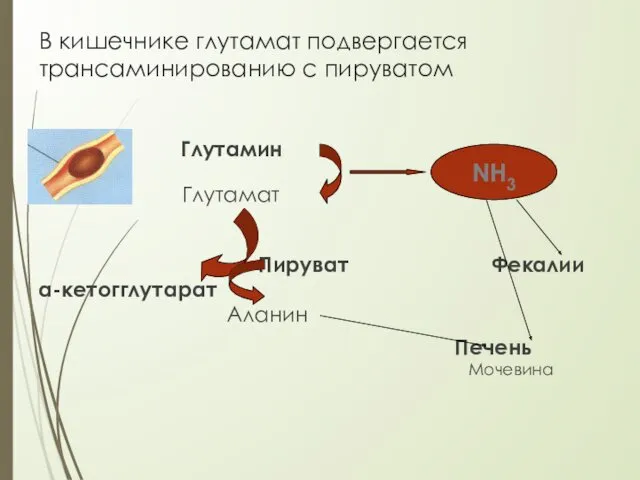
- 24. В кишечнике глутамат подвергается трансаминированию с пируватом Глутамин Глутамат Пируват Фекалии α-кетогглутарат Аланин Печень Мочевина
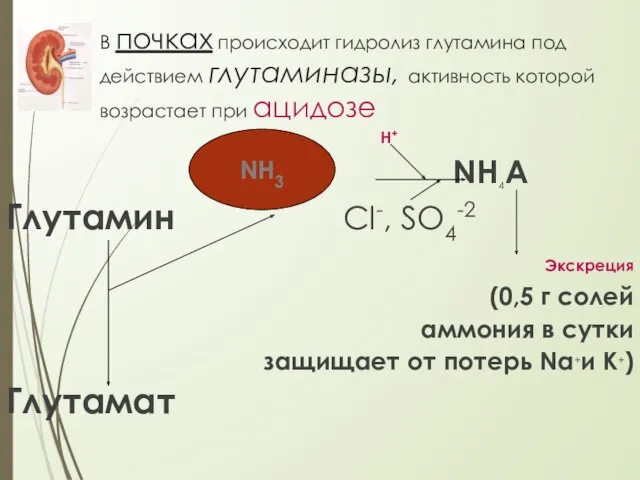
- 25. В почках происходит гидролиз глутамина под действием глутаминазы, активность которой возрастает при ацидозе Н+ NH4А Глутамин
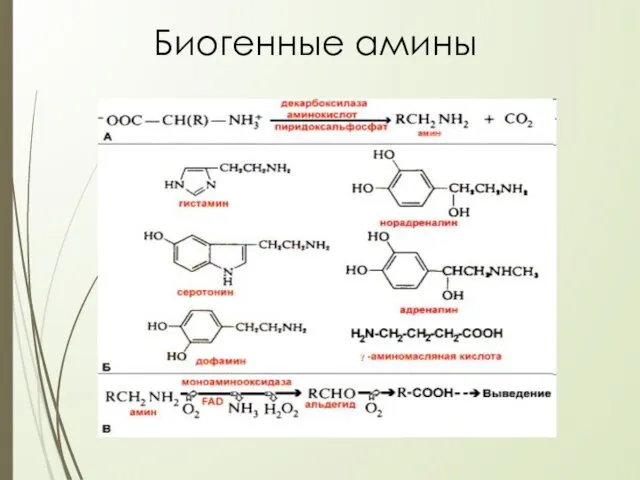
- 26. Декарбоксилирование аминокислот – отщепление α -карбоксильной группы аминокислот с образованием аминов Реакция катализируется декарбоксилазами, коферментом которых
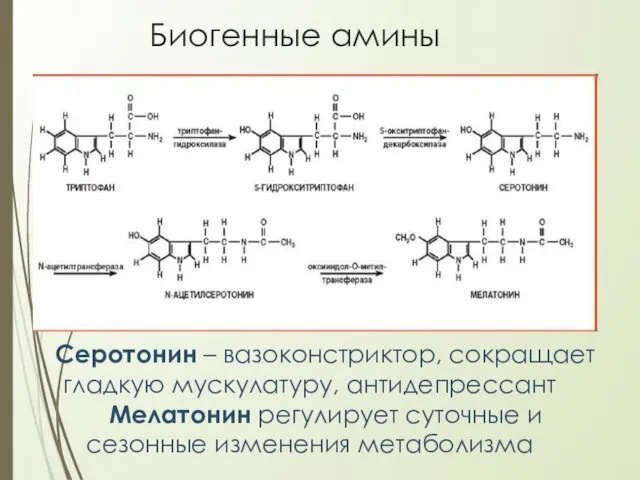
- 27. Биогенные амины Серотонин – вазоконстриктор, сокращает гладкую мускулатуру, антидепрессант Мелатонин регулирует суточные и сезонные изменения метаболизма
- 28. Биогенные амины
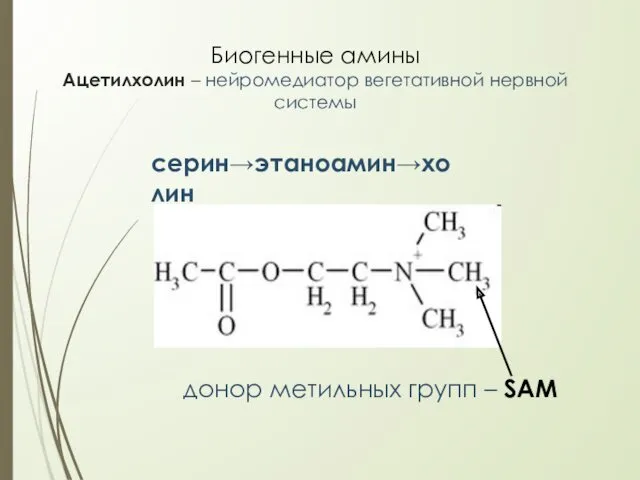
- 29. Биогенные амины Ацетилхолин – нейромедиатор вегетативной нервной системы донор метильных групп – SAM серин→этаноамин→холин
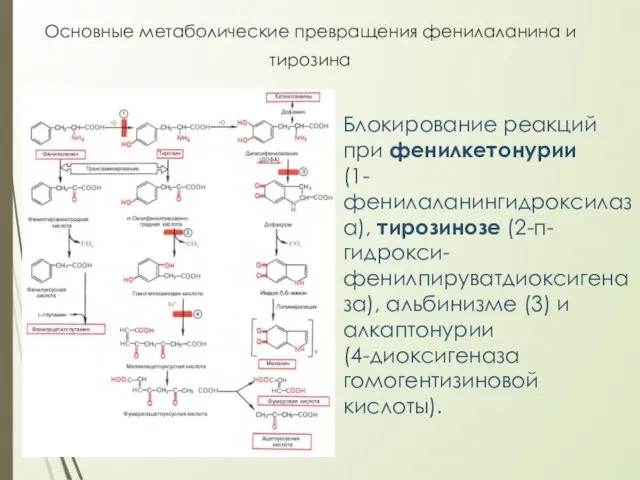
- 30. Основные метаболические превращения фенилаланина и тирозина Блокирование реакций при фенилкетонурии (1-фенилаланингидроксилаза), тирозинозе (2-п-гидрокси-фенилпируватдиоксигеназа), альбинизме (3) и
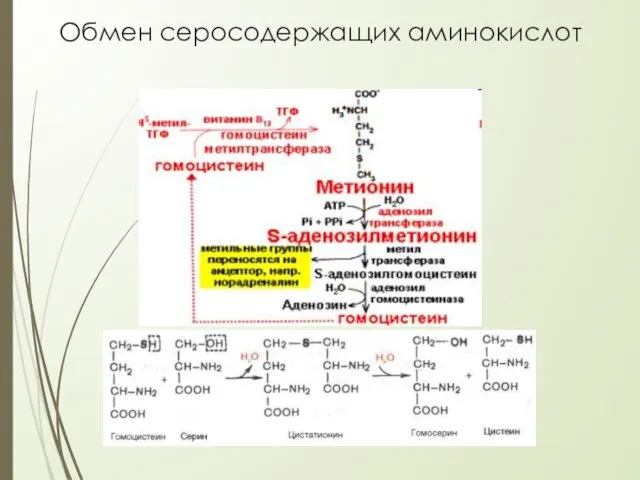
- 31. Обмен серосодержащих аминокислот
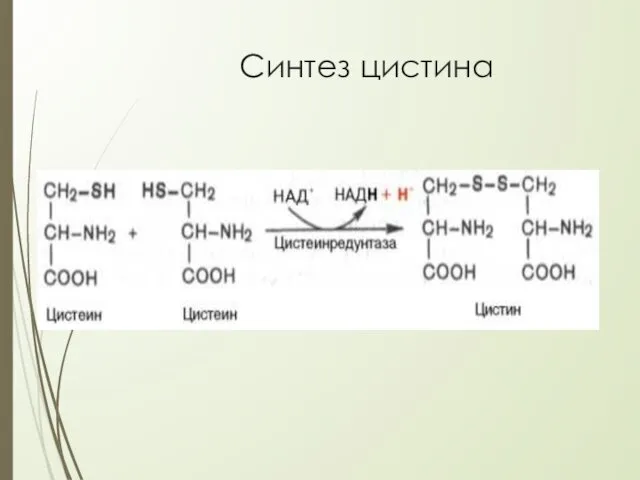
- 32. Cинтез цистина
- 34. Скачать презентацию




















 Жизненный цикл клетки
Жизненный цикл клетки Класс Птицы. Происхождение и особенности внутреннего строения, связанные с полётом. 7 класс
Класс Птицы. Происхождение и особенности внутреннего строения, связанные с полётом. 7 класс Геномный импринтинг. Однородительская дисомия
Геномный импринтинг. Однородительская дисомия Рынок биотехнологий и государственные программы развития биотехнологий в РФ
Рынок биотехнологий и государственные программы развития биотехнологий в РФ Хромосомний імпринтинг. Однобатьківська дисомія. Фенокопії
Хромосомний імпринтинг. Однобатьківська дисомія. Фенокопії Современная зоология
Современная зоология Клітинний кворум. Наявність розвиненої системи міжклітинного сигналінгу
Клітинний кворум. Наявність розвиненої системи міжклітинного сигналінгу Тип плоские черви. Тип круглые черви. Тип кольчатые черви
Тип плоские черви. Тип круглые черви. Тип кольчатые черви Красная книга. Животные и растения, которые находятся на грани вымирания
Красная книга. Животные и растения, которые находятся на грани вымирания Презентация Отряд прямокрылые
Презентация Отряд прямокрылые Chemical senses. Taste
Chemical senses. Taste Презентация Архитектурная бионика
Презентация Архитектурная бионика Лабораторные работы по биомеханике
Лабораторные работы по биомеханике Развитие конечного мозга. Плащ, корковые концы анализаторов
Развитие конечного мозга. Плащ, корковые концы анализаторов Орган слуха и равновесия
Орган слуха и равновесия Углеводы. Строение и функции основных углеводов
Углеводы. Строение и функции основных углеводов Презентация по биологии на тему Размножение и развитие птиц
Презентация по биологии на тему Размножение и развитие птиц Презентация Использование игрового метода на уроках биологии
Презентация Использование игрового метода на уроках биологии презентация по биологии Экологическая задача Ч.Дарвина
презентация по биологии Экологическая задача Ч.Дарвина Растения Дальнего Востока
Растения Дальнего Востока Строение и работа сердца
Строение и работа сердца Бұлшық ет құрылысы
Бұлшық ет құрылысы Бактерии. Группы настоящих бактерий
Бактерии. Группы настоящих бактерий Сад и его обитатели
Сад и его обитатели Матричные биосинтезы
Матричные биосинтезы Урок по теме Многообразие рыб
Урок по теме Многообразие рыб В гости к осени. 2 класс
В гости к осени. 2 класс Среда обитания первых форм жизни. Происхождение нуклеотидов и РНК
Среда обитания первых форм жизни. Происхождение нуклеотидов и РНК