Содержание
- 2. Степень окисления элементов Степень окисления – условный заряд («+» или «–»), который образуется на атомах Х.Э.,
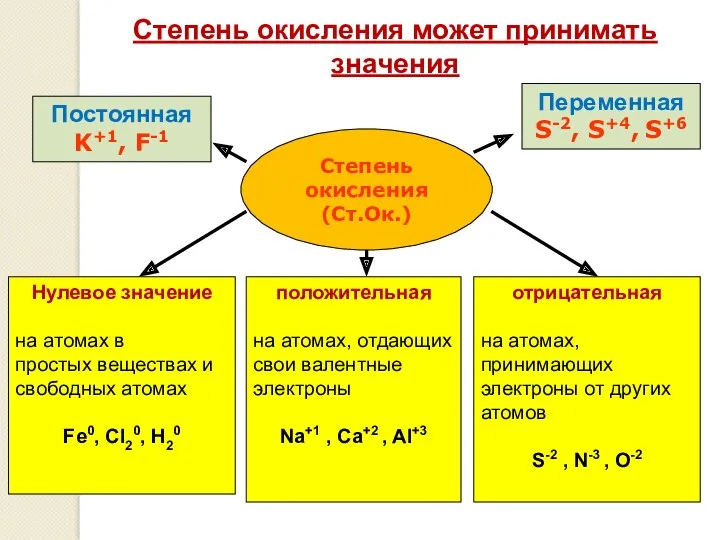
- 3. Степень окисления (Ст.Ок.) Степень окисления может принимать значения Постоянная K+1, F-1 Переменная S-2, S+4, S+6 Нулевое
- 4. Правила определения степени окисления . Степени окисления атомов в простых веществах равны нулю (Н20,СI20, S0, AI0)
- 5. Правила определения степени окисления Кислород в большинстве случаев имеет степень окисления «-2» (H2+1O-2 ) Исключением являются:
- 6. Правила определения степени окисления Неметаллы в соединениях могут иметь положительную и отрицательную степень окисления. Её максимальное
- 7. Составление формул по степени окисления АЛГОРИТМ: Записать химические знаки элементов Al S На первом месте, как
- 8. Определение степеней окисления по формуле бинарных соединений В соединениях суммарная степень окисления всегда равна нулю. Зная
- 9. Определение степеней окисления в соединениях, где более двух х.э. Определим степени окисления х.э. в соединении Na3PO4
- 11. Скачать презентацию







 Связь структуры и функций химических соединений. Задачи QSAR
Связь структуры и функций химических соединений. Задачи QSAR Соединения химических элементов
Соединения химических элементов МЫШЬЯК
МЫШЬЯК Кривая охлаждения железа и структуры сплавов
Кривая охлаждения железа и структуры сплавов Фазовые равновесия и учение о растворах
Фазовые равновесия и учение о растворах Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда
Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда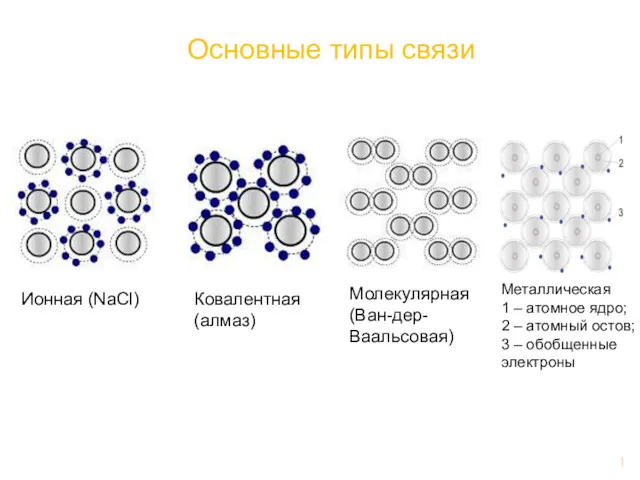 Основные типы связи
Основные типы связи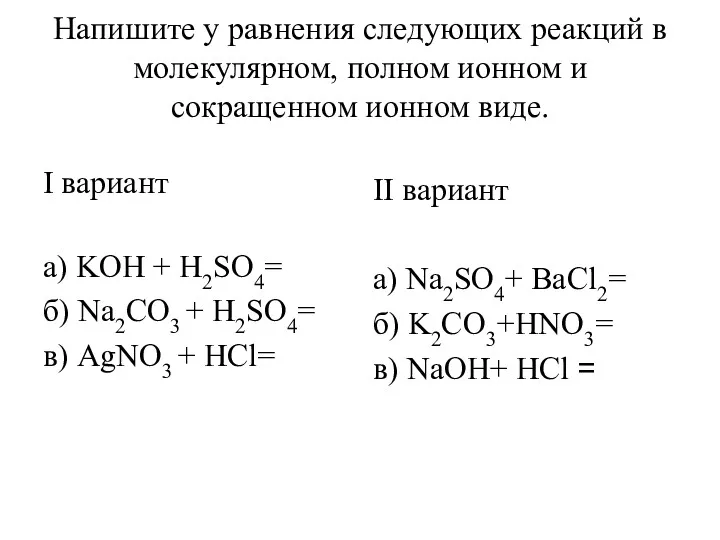 Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде
Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде Производство метанола. Физико-химические основы синтеза метанола. Современные катализаторы
Производство метанола. Физико-химические основы синтеза метанола. Современные катализаторы Кремний. Применение кремния
Кремний. Применение кремния Положение тугоплавких металлов в Периодической системе элементов
Положение тугоплавких металлов в Периодической системе элементов Дисперсные системы
Дисперсные системы Галогены. История открытия галогенов
Галогены. История открытия галогенов Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Алюминий и его соединения
Алюминий и его соединения Жидкостная экстракция
Жидкостная экстракция Аккумуляторные батареи
Аккумуляторные батареи Химическая связь
Химическая связь Жир жиру рознь. Супер омега 3
Жир жиру рознь. Супер омега 3 Історія хімії
Історія хімії Органическая химия. Жиры
Органическая химия. Жиры Классификация кристаллов по типу химической связи
Классификация кристаллов по типу химической связи Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Химические свойства основных оксидов
Химические свойства основных оксидов Использование горюче-смазочных материалов в автотранспорте
Использование горюче-смазочных материалов в автотранспорте