Слайд 2

Задание 37 № 1627.
Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь
продуктов отработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор. Запишите уравнения описанных реакций.
Слайд 3

Слайд 4

Задание 37 № 1630.
Смесь порошков нитрита калия и хлорида аммония растворили в воде
и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Запишите уравнения описанных реакций.
Слайд 5

Слайд 6

Задание 37 № 1632.
Хлор прореагировал с горячим раствором гидроксида калия. При охлаждении раствора
выпали кристаллы бертолетовой соли. Полученные кристаллы внесли в раствор соляной кислоты. Образовавшееся простое вещество прореагировало с металлическим железом. Продукт реакции нагрели с новой навеской железа. Запишите уравнения описанных реакций.
Слайд 7

Слайд 8

Задание 37 № 1635.
Кристаллы хлорида калия обработали концентрированной серной кислотой. К получившейся соли
добавили гидроксид калия. К полученному продукту прилили раствор хлорида бария. Выпавший осадок отфильтровали, после чего прокалили с избытком угля. Запишите уравнения описанных реакций.
Слайд 9

Слайд 10

Задание 37 № 1640.
Две соли окрашивают пламя в фиолетовый цвет. Одна из них
бесцветна, и при лёгком нагревании её с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа. При добавлении к раствору второй соли раствора серной кислоты жёлтая окраска раствора изменяется на оранжевую, а при нейтрализации полученного раствора щёлочью восстанавливается первоначальный цвет. Напишите уравнения описанных реакций.
Слайд 11

Пояснение.
В фиолетовый цвет окрашивают пламя соли калия. Медь с выделением бурого
газа растворяется в концентрированной азотной кислоте (уравнение 2), следовательно, одна из солей — KNО3, взаимодействие её с концентрированной серной кислотой используется для получения концентрированной HNО3 — жидкости с температурой кипения 82,6 °С (уравнение 1). Вторая соль — К2СrО4; для хроматов характерно изменение окраски на оранжевую в растворах кислот (уравнение 3) и приобретение прежней окраски при нейтрализации (уравнение 4).
Слайд 12

Задание 37 № 1641.
Вещество, выделяющееся на катоде при электролизе расплава хлорида натрия, сожгли
в кислороде. Полученный продукт поместили в газометр, наполненный углекислым газом. Образовавшееся вещество добавили в раствор хлорида аммония и раствор нагрели. Напишите уравнения описанных реакций.
Слайд 13

Пояснение.
При электролизе расплава соли на катоде выделяется металл (уравнение 1). При
горении натрия преимущественно образуется пероксид натрия (уравнение 2), который реагирует с углекислым газом с выделением кислорода (уравнение 3). При нагревании раствора, содержащего NH4Cl (соль, образованная слабым основанием и сильной кислотой) и Na2CО3 (соль, образованная сильным основанием и слабой кислотой), будет происходить гидролиз (уравнение 4).
Слайд 14

Задание 37 № 1642.
Продукт взаимодействия азота и лития обработали водой. Выделившийся в результате
реакции газ смешали с избытком кислорода и при нагревании пропустили над платиновым катализатором; образовавшаяся газовая смесь имела бурый цвет. Напишите уравнения описанных реакций.
Слайд 15

Пояснение.
При взаимодействии азота и лития образуется нитрид лития (уравнение 1), который
легко разлагается водой с выделением аммиака (уравнение 2). Аммиак окисляется кислородом в присутствии платинового катализатора до оксида азота (II), не имеющего цвета (уравнение 3). Образование бурого газа NO2 из NO происходит легко и самопроизвольно (уравнение 4).
Слайд 16

Задание 37 № 1624.
Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали
сначала образование осадка, а затем - его полное растворение. Образовавшуюся при этом иодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. Полученный оксид прореагировал с угарным газом. Запишите уравнения описанных реакций.
Слайд 17
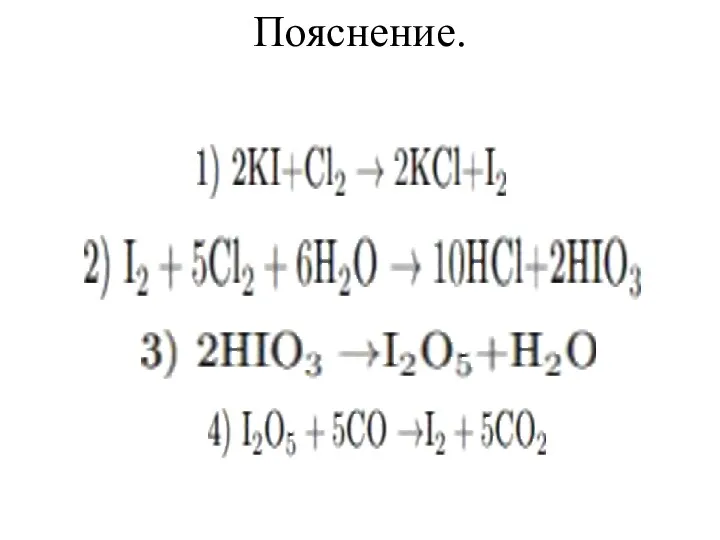
Слайд 18

Расставьте коэффициенты методом электронного баланса в следующих схемах реакций:
1) KNO3→KNO2+O2↑
2) KClO3→KClO4+KCl
3)
H2O2+KI→I2+KOH
4) NO2+KOH→KNO2+KNO3+H2O
5) Na + HNO3 → NaNO3 + N2O + H2O
6) K2FeO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + H2O + O2
7) H2O2 + KMnO4 + HNO3 → Mn(NO3)2 + KNO3 + H2O + O2
8) Ti2(SO4)3 + KClO3 + H2O → TiOSO4 + KCl + H2SO4
Слайд 19

Задание 37 № 1629.
Магний растворили в разбавленной азотной кислоте, причём выделение газа не
наблюдалось. Получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Запишите уравнения описанных реакций.
Слайд 20

Слайд 21

Задание 37 № 1643.
Продукт взаимодействия фосфида магния с водой сожгли и продукты реакции
поглотили водой. Образовавшееся вещество используется в промышленности для получения двойного суперфосфата из фосфорита. Напишите уравнения описанных реакций.
Слайд 22

Пояснение.
Фосфид магния гидролизутся водой (уравнение 1) с выделением фосфина РН3, бесцветного
газа с чесночным запахом, самовоспламеняющегося и горящего на воздухе (уравнение 2). Оксид фосфора (V) взаимодействует с избытком воды и образует ортофосфорную кислоту (уравнение 3). Двойной суперфосфат — кислая соль ортофосфорной кислоты, растворимая в воде; его получают из фосфата кальция и ортофосфорной кислоты (уравнение 4).
Слайд 23

Задание 37 № 1644.
Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали
холодной водой и выделяющийся газ пропустили через горячую воду Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
Слайд 24

Пояснение.
При сплавлении магния и кремния образуется силицид магния (уравнение 1), который
будет гидролизоваться водой с образованием нерастворимого Mg(OH)2 и газообразного силана SiH4 (уравнение 2). Горячей водой силан разлагается с образованием водорода и твёрдого диоксида кремния (уравнение 3). При сплавлении диоксида кремния с гидроксидом натрия будет образовываться силикат натрия, используемый в промышленности под названием «жидкое стекло» (уравнение 4).
Слайд 25

Задание 37 № 1647.
Кальций нагрели в атмосфере водорода. Продукт реакции обработали водой, выделяющийся
газ пропустили над нагретым оксидом цинка, а в раствор добавили кальцинированную соду. Напишите уравнения описанных реакций.
Слайд 26

Пояснение.
При взаимодействии очень активного металла кальция с водородом образуется гидрид кальция
(уравнение 1). Гидрид кальция взаимодействует с водой с образованием гидроксида кальция и выделением водорода (уравнение 2). Водород способен восстанавливать некоторые металлы из их оксидов (уравнение 3). При добавлении в раствор Са(ОН)2 кальцинированной соды образуется нерастворимый карбонат кальция и в растворе остаётся щёлочь (уравнение 4); эта реакция раньше использовалась для получения едкого натра.
Слайд 27

Задание 37 № 3991.
Газ, полученный при обработке нитрида кальция водой, пропустили над раскалённым
порошком оксида меди(II). Полученное при этом твёрдое вещество растворили в концентрированной азотной кислоте, раствор выпарили, а полученный твёрдый остаток прокалили. Составьте уравнения четырёх описанных реакций.

























 Protein and amino acid metabolism
Protein and amino acid metabolism Спирты. Лекция
Спирты. Лекция Свойства НЦ
Свойства НЦ Марганец. Железо
Марганец. Железо Фосфор и его соединения
Фосфор и его соединения Основні класи неорганічних сполук
Основні класи неорганічних сполук Спектроскопия лазерных кристаллов
Спектроскопия лазерных кристаллов Соли: карбонаты, галоиды, сульфаты
Соли: карбонаты, галоиды, сульфаты Основы электрохимии
Основы электрохимии Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Окислительно-восстановительные реакции. Лабораторная работа
Окислительно-восстановительные реакции. Лабораторная работа Получение высокодисперсных проводящих оксидов - носителей платинового катализатора для низкотемпературных топливных элементов
Получение высокодисперсных проводящих оксидов - носителей платинового катализатора для низкотемпературных топливных элементов Смог и его виды
Смог и его виды Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Каменный уголь. Фенол
Каменный уголь. Фенол Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Алкадиены
Алкадиены Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Электрохимические накопители энергии
Электрохимические накопители энергии Непредельные углеводороды
Непредельные углеводороды Mercury. Mercury cycle
Mercury. Mercury cycle Валентність хімічних елементів
Валентність хімічних елементів Реакции ионного обмена
Реакции ионного обмена Коллоидная химия
Коллоидная химия Природный и попутный нефтяные газы
Природный и попутный нефтяные газы Алкины. Гомологический ряд
Алкины. Гомологический ряд Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций