Содержание
- 2. Схема получения НЦ
- 3. Выход НЦ
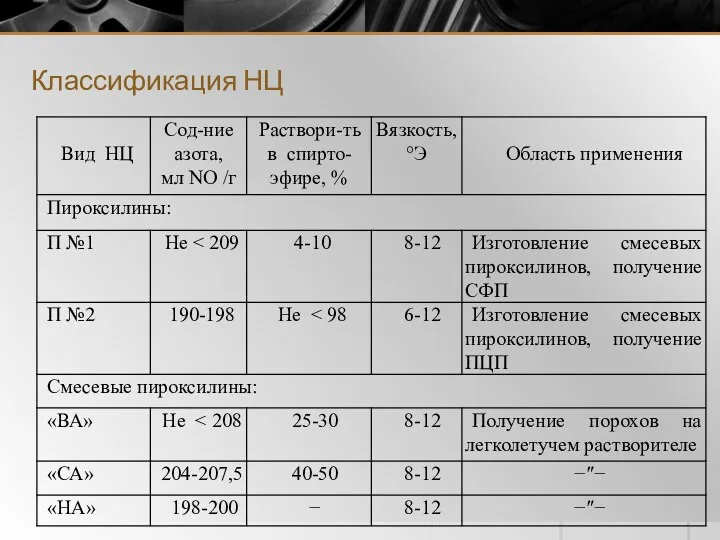
- 4. Классификация НЦ
- 5. Классификация НЦ (продолжение табл.)
- 6. Растворимость НЦ Группы растворителей НЦ 1. Собственно растворители – вещества, образующие с НЦ истинные макро-молекулярные растворы
- 7. Влияние содержания N на растворимость НЦ в орг. растворителях
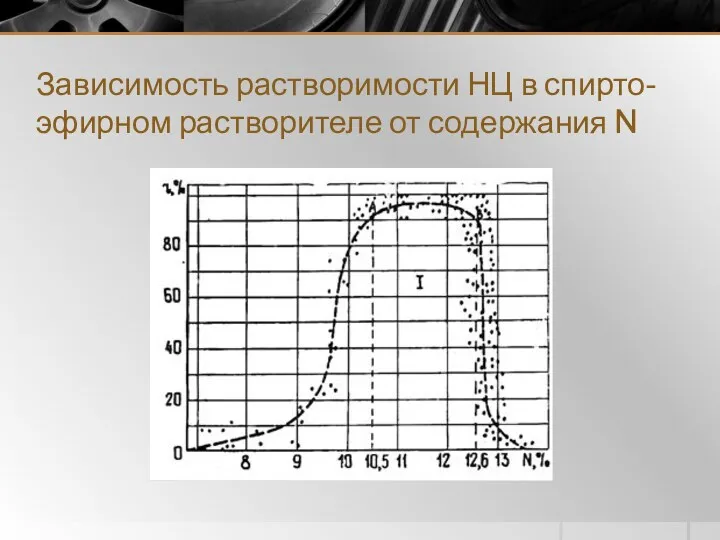
- 8. Зависимость растворимости НЦ в спирто-эфирном растворителе от содержания N
- 9. Факторы, влияющие на растворимость Степень полимеризации (↑ ВМ фракций ↓ растворимость); Степень измельчения (↑ степени измельчения
- 10. Вязкость растворов Согласно Штаудингеру зависимость удельной вязкости растворов НЦ от их молекулярной массы можно выразить соотношением:
- 11. Факторы, влияющие на вязкость Природа и состав растворителей. Чем активнее растворитель, тем меньше вязкость растворов НЦ.
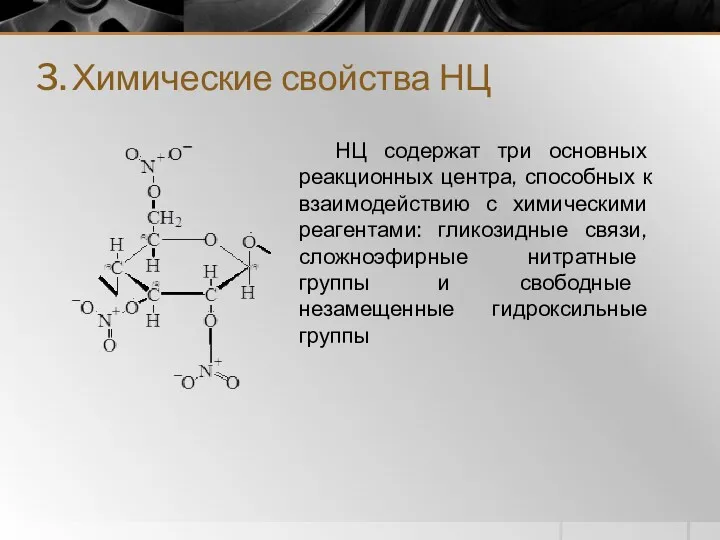
- 12. 3. Химические свойства НЦ НЦ содержат три основных реакционных центра, способных к взаимодействию с химическими реагентами:
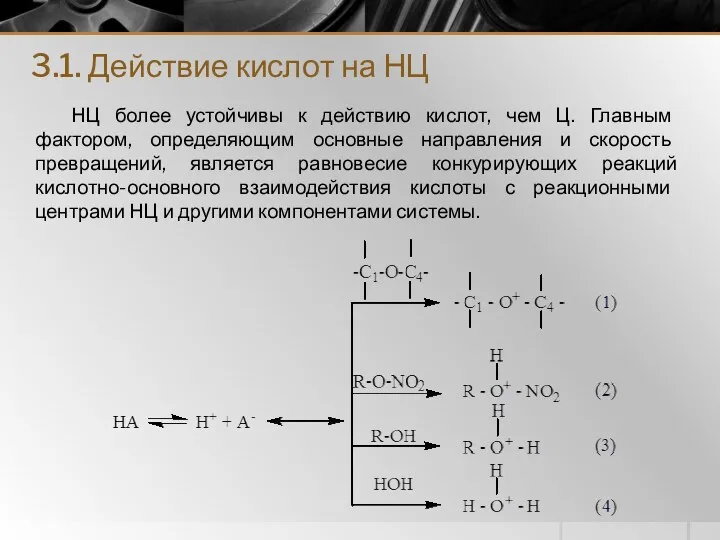
- 13. 3.1. Действие кислот на НЦ НЦ более устойчивы к действию кислот, чем Ц. Главным фактором, определяющим
- 14. Гидролитическая деструкция НЦ Расщепление органических нитратов на спирт и воду (денитрация или омыление) При малых концентрациях
- 15. 3.2. Действие щелочей на НЦ Механизм действия щелочей на органические нитраты: Для большинства нитратов все три
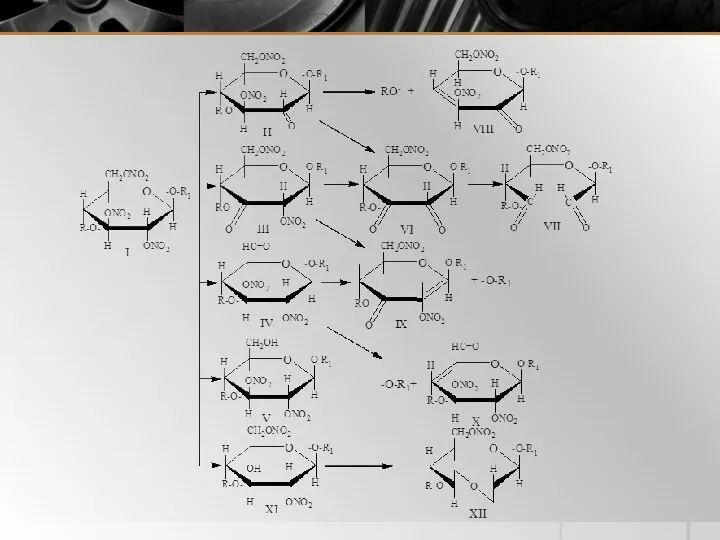
- 17. 3.3.1 Действие окислителей НЦ сравнительно устойчивы к действию окислителей. Даже такие сильные окислители, как перманганат калия,
- 18. 3.3.2 Действие восстановителей Восстановители энергично взаимодействуют с НЦ с выделением азотной и азотистой кислот, оксидов азота
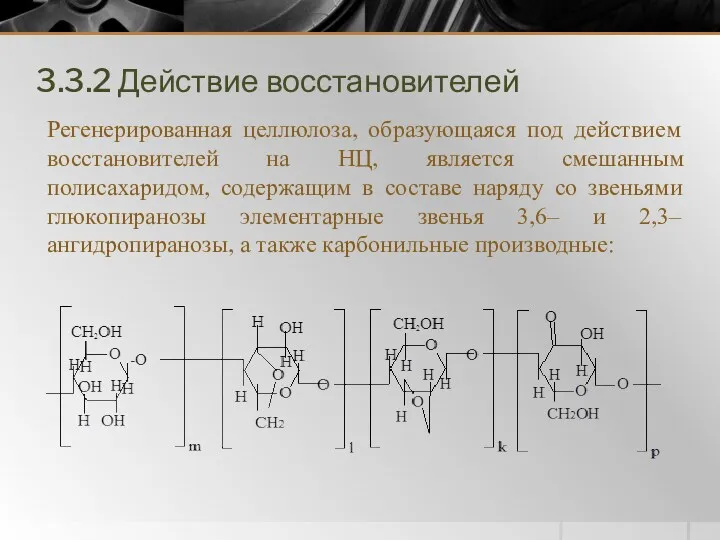
- 19. 3.3.2 Действие восстановителей Регенерированная целлюлоза, образующаяся под действием восстановителей на НЦ, является смешанным полисахаридом, содержащим в
- 20. Значение химических свойств НЦ для производства Гидролизующее действие кислот используется в производстве НЦ для регулирования их
- 21. Химическая стойкость НЦ Химическая стойкость НЦ – это способность сохранять неизменными физико-химические свойства в течение определенного
- 22. Продуктом первичного распада НЦ является NO2, который при последующем взаимодействии с исходным НЦ и промежуточными продуктами
- 23. Появление кислот в НЦ инициирует развитие процессов гидролитического распада (см. 3.1). Гидролиз сложноэфирной группы приводит к
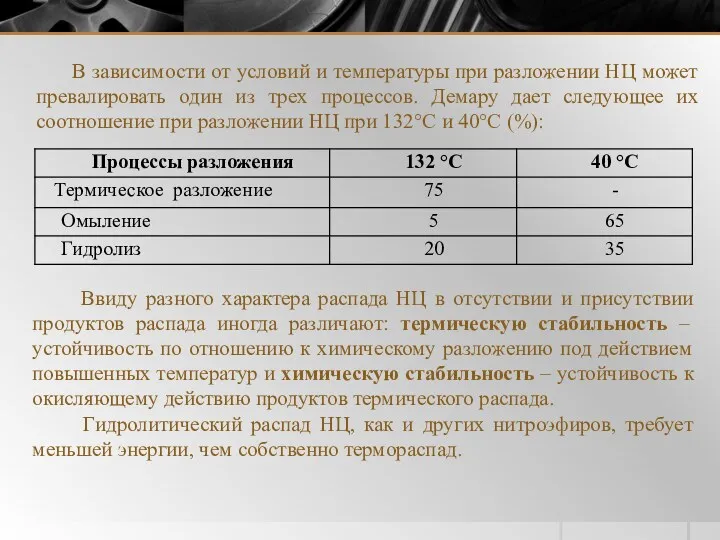
- 24. В зависимости от условий и температуры при разложении НЦ может превалировать один из трех процессов. Демару
- 26. Скачать презентацию
















 Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5
Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5 Кремний и его соединения
Кремний и его соединения Основные понятия и законы химии. Тема 1
Основные понятия и законы химии. Тема 1 Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) 20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii
20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii Икаит Ca[CO3]·6 (H2O)
Икаит Ca[CO3]·6 (H2O) Фосфаты и фосфонаты в стиральном порошке
Фосфаты и фосфонаты в стиральном порошке Электоролиз заңы
Электоролиз заңы Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Классификация органических веществ
Классификация органических веществ Одноатомные спирты. Глицерин
Одноатомные спирты. Глицерин 20230204_ekzo_i_endo2_0
20230204_ekzo_i_endo2_0 Горение жидкого топлива
Горение жидкого топлива Равновесие в реакциях гидролиза. Лекция 6
Равновесие в реакциях гидролиза. Лекция 6 Аналитическая химия
Аналитическая химия Химические свойства алкенов
Химические свойства алкенов Вещества в твоей жизни
Вещества в твоей жизни Алкани
Алкани Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация
Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация Карбоновые кислоты и их гетерофункциональные производные
Карбоновые кислоты и их гетерофункциональные производные Чистые вещества и смеси
Чистые вещества и смеси Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия Алкины. Самостоятельная работа
Алкины. Самостоятельная работа Современные методы физико-химической биологии
Современные методы физико-химической биологии Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии