Содержание
- 2. Теория электролитической диссоциации (ТЭД).
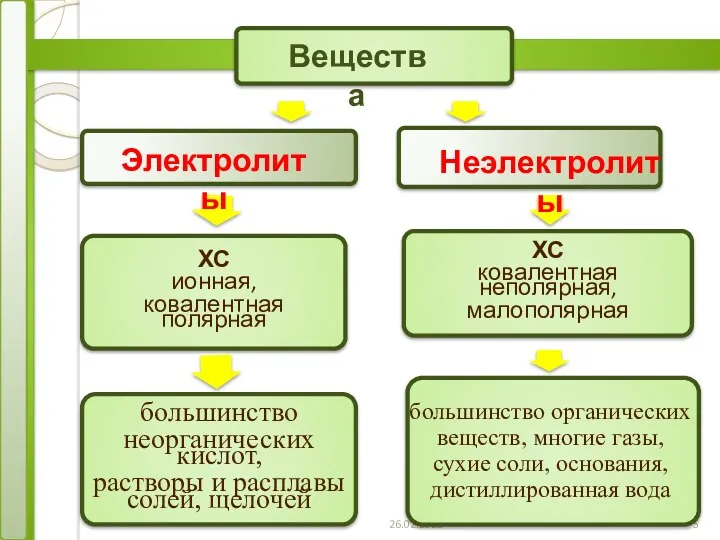
- 3. Содержание Электролиты и неэлектролиты Теория электролитической диссоциации Механизм электролитической диссоциации веществ с ионной связью Механизм электролитической
- 4. Все вещества по отношению к электрическому току можно разделить на электролиты и неэлектролиты. Электролиты – вещества,
- 5. 26.02.2023 1 Электролиты Неэлектролиты
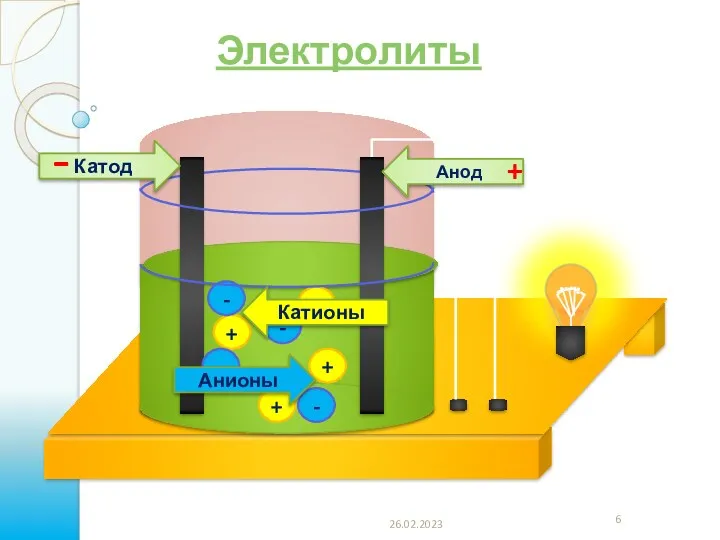
- 6. + + + + - - - - Анионы Катионы Анод Катод - + 26.02.2023 Электролиты
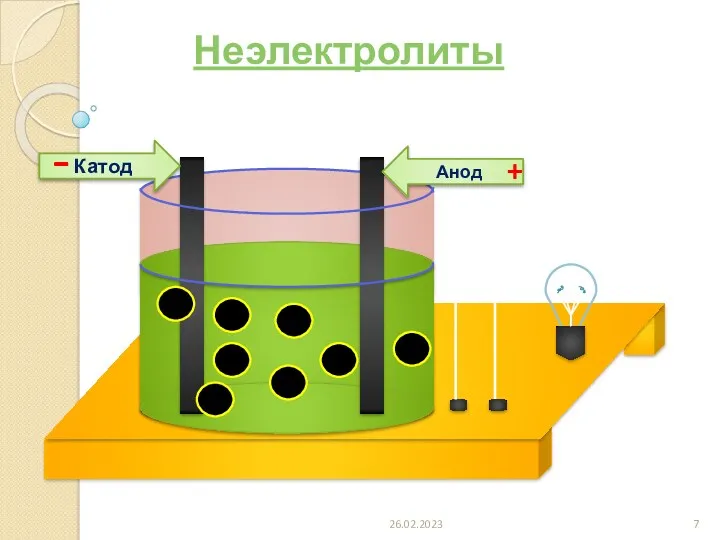
- 7. Анод Катод - + 26.02.2023 Неэлектролиты
- 8. 26.02.2023 2.Электролитическая диссоциация Аррениус Сванте Август Шведский ученый, академик. В 1887 году сформулировал основные положения теории
- 9. Существенный вклад в развитие ТЭД внесли русские ученые И.А. Каблуков и В.А. Кистяковский. Кистяковский Владимир Александрович
- 10. Электролитическая диссоциация – процесс распада электролита на ионы. 1. Все вещества по способности диссоциировать в растворе
- 11. 3. Ионы непрерывно движутся. Происходит ассоциация - притяжение противоположно заряженных ионов с образованием частиц электролита. Диссоциация
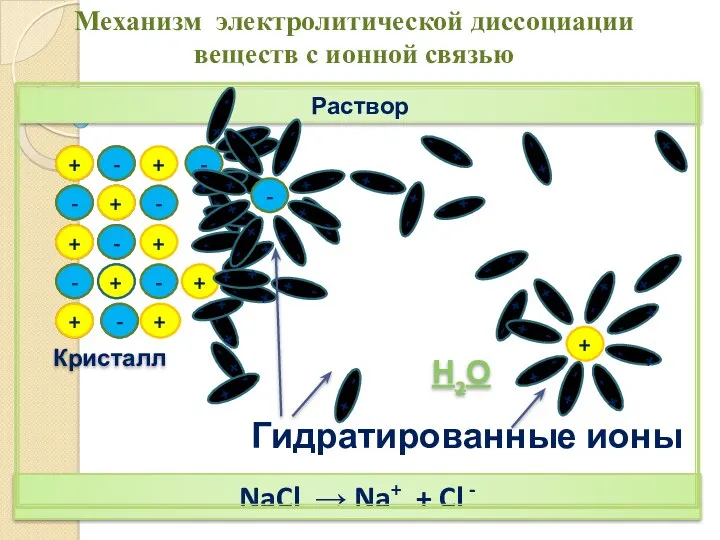
- 12. + + - - + + - - Раствор Кристалл - + + + - -
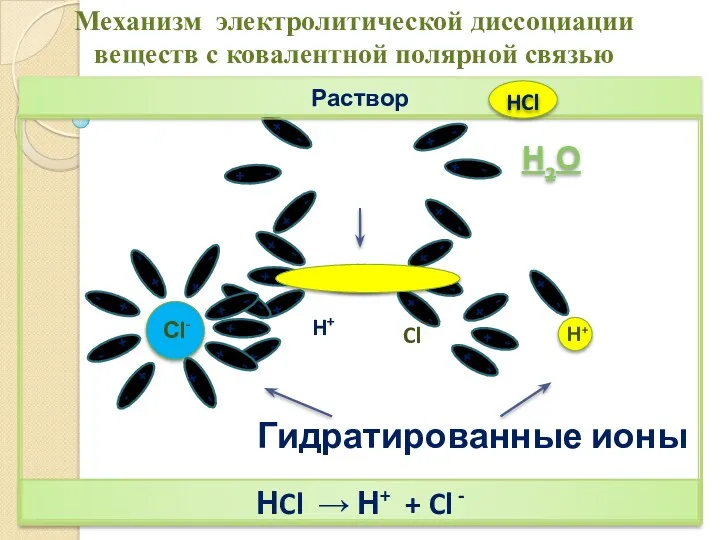
- 13. Раствор НCl → Н+ + Cl - Механизм электролитической диссоциации веществ с ковалентной полярной связью Н2О
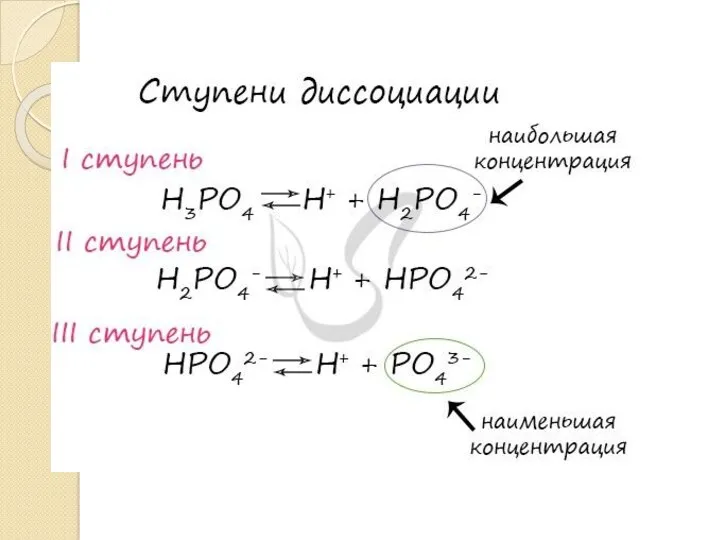
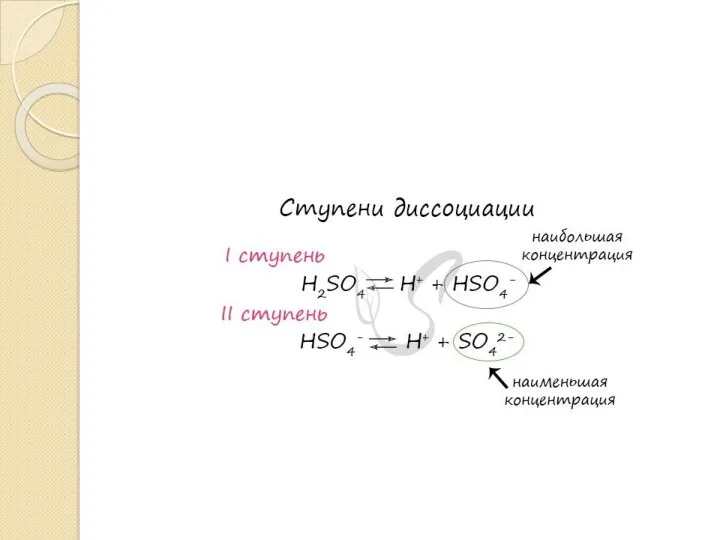
- 14. 26.02.2023 Степень электролитической диссоциации (α) - отношение числа частиц, распавшихся на ионы (n) к общему числу
- 15. Константа диссоциации – отношение произведения концентрации продуктов диссоциации к концентрации недиссоциированных молекул.
- 16. 2.Сильные и слабые электролиты HCl + + + Сильные и слабые Рис.6.
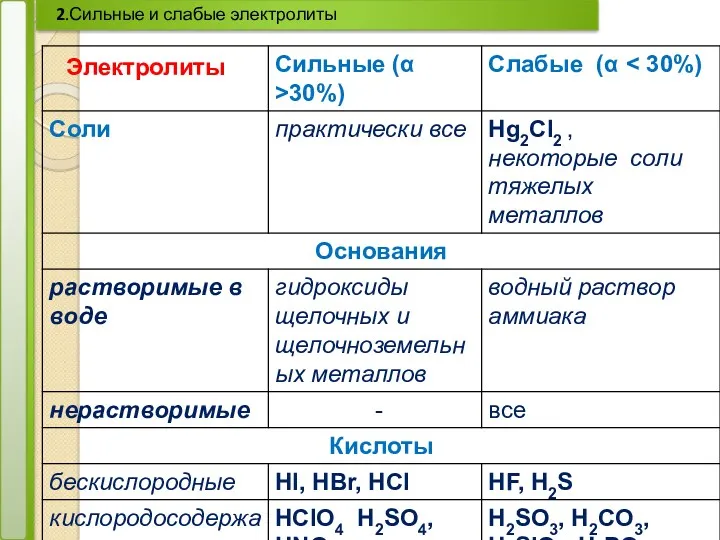
- 17. 2.Сильные и слабые электролиты Электролиты
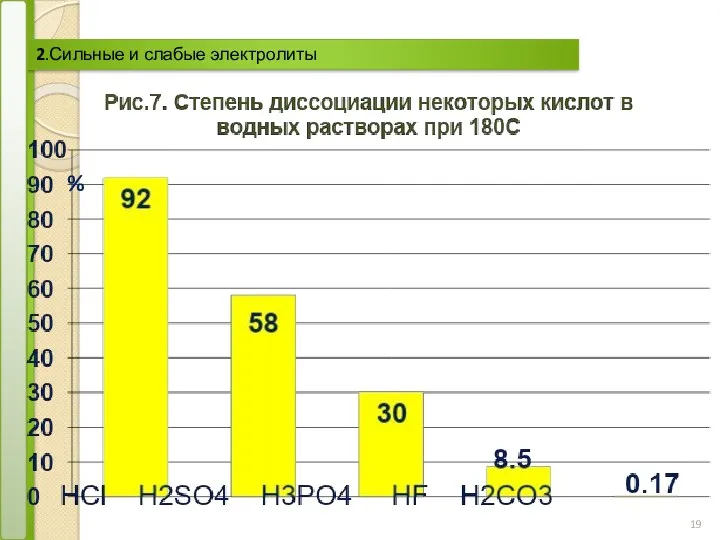
- 19. 2.Сильные и слабые электролиты %
- 20. 6. О значении электролитов для живых организмов Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных
- 21. Характерные симптомы дефицита химических элементов в организме человека подробнее
- 27. Скачать презентацию













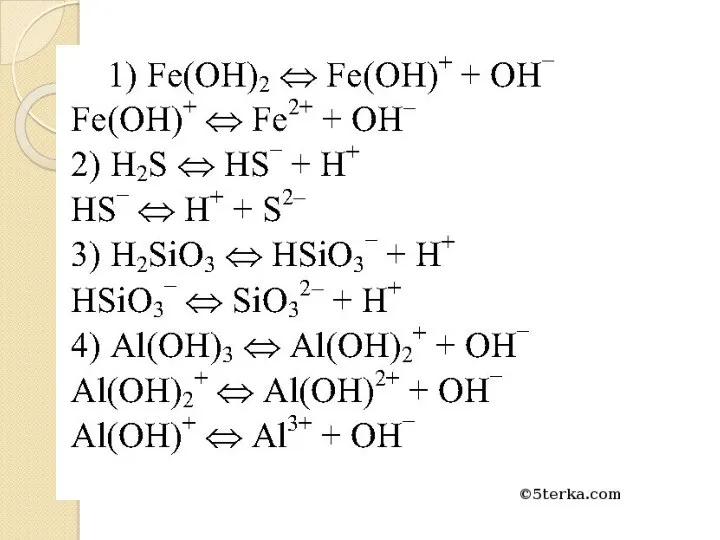
 Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева
Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева Общая характеристика неметаллов
Общая характеристика неметаллов Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Вода – основа жизни на Земле
Вода – основа жизни на Земле Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії Азот
Азот Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии Соли. Названия солей
Соли. Названия солей Пиролиз углеводородов
Пиролиз углеводородов Минерал чароит. Месторождения
Минерал чароит. Месторождения Магний (Mg)
Магний (Mg) Жоғары молекулалық қосылыстар химиясы
Жоғары молекулалық қосылыстар химиясы Углеводы (сахариды)
Углеводы (сахариды) α-Аминокислоты. Белки
α-Аминокислоты. Белки Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс
Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс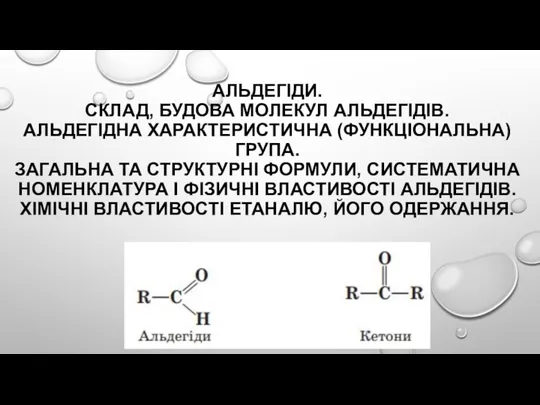 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Химическая кинетика. Раздел 2
Химическая кинетика. Раздел 2 Химические свойства солей
Химические свойства солей Органикалық заттардың ерекшелігі
Органикалық заттардың ерекшелігі Характеристика элементов VIIA-группы (галогены)
Характеристика элементов VIIA-группы (галогены) Соединения водорода
Соединения водорода Кристаллохимия негіздері
Кристаллохимия негіздері Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5)