Содержание
- 2. Электродные потенциалы
- 3. О направлении протекания ОВР можно судить по величине ΔG системы. Кроме того, для количественной характеристики окислительно-восстановительной
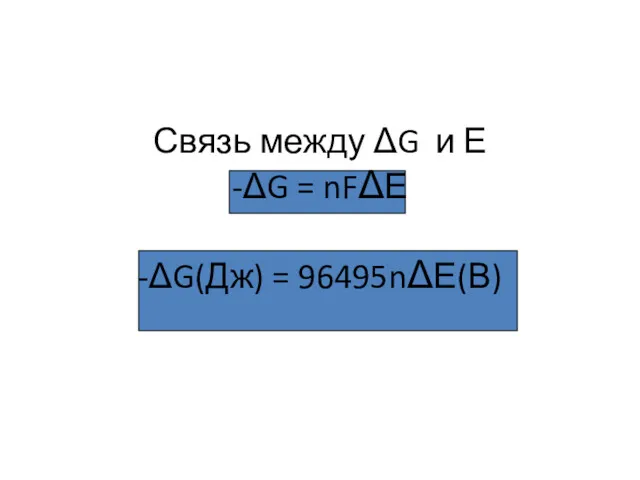
- 4. Связь между ΔG и Е -ΔG = nFΔЕ -ΔG(Дж) = 96495nΔЕ(В)
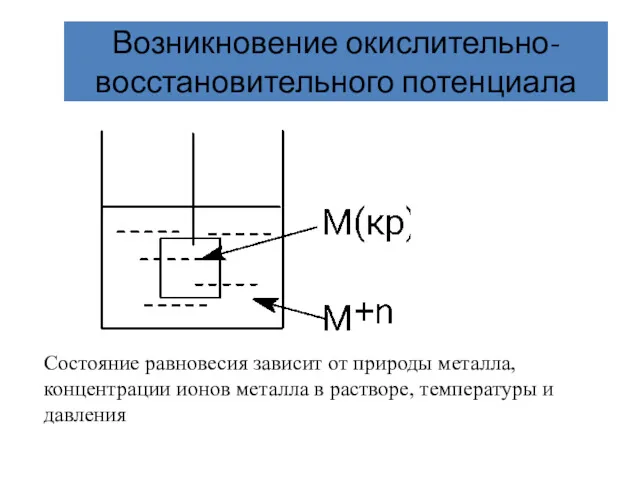
- 5. Возникновение окислительно-восстановительного потенциала Состояние равновесия зависит от природы металла, концентрации ионов металла в растворе, температуры и
- 6. Окислительно-восстановительный потенциал Электродный потенциал (Е) – это разность потенциалов, возникающая между металлом и окружающей его жидкой
- 7. При СМ (ионов) = 1 моль/л и Т = 298 К Е = Е0 В других
- 8. Стандартный электродный потенциал (Е0) После подстановки: Е = Е0 +
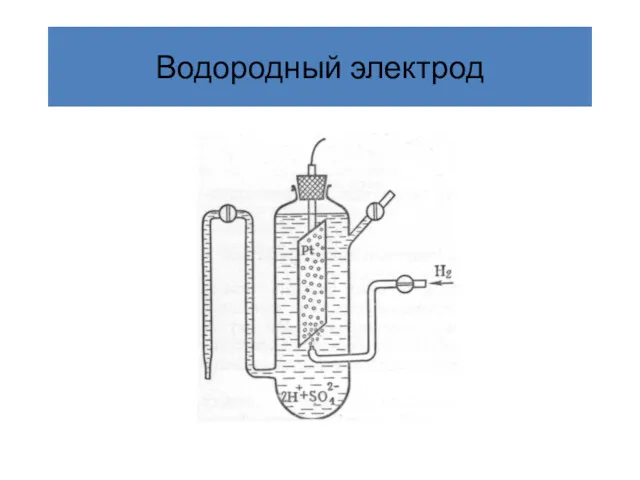
- 9. Измерение величины Е Величину стандартного электродного потенциала определяют по отношению к водородному электроду, стандартный электродный потенциал
- 10. Водородный электрод H2 ⮀ 2H+ H(Pt) ⮀ H+(р-р) + ℮ H2(Pt) ⮀ 2H+(р-р) + 2℮ =
- 11. Водородный электрод
- 12. Измерение электродного потенциала ЭДС = Еизм - = Еизм
- 13. Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют электрохимический ряд напряжений металлов (ряд активности
- 14. Направление окислительно-восстановительных реакций ΔG0 = -nFΔЕ0, , где ΔЕ0=ЭДС=Е0(ок)-Е0(восст). Для того, чтобы ОВР была возможна, необходимо
- 15. Направление окислительно-восстановительных реакций Пример: Fe + ZnSO4 → FeSO4 + Zn Восстановитель Fe0 – 2e- =
- 16. Пример: Zn + FeSO4 → ZnSO4 + Fe Окислитель Fe2+ + 2e- = Fe0 Восстановитель Zn0-
- 17. О связи между ΔЕ0 и ΔG0 реакции ΔG0 = -nFΔЕ0, ΔG0 = -RTlnKp RTlnKp = nFΔЕ0
- 18. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- 19. Гальванический элемент Схема гальванического элемента [Н.С.Ахметов. С.223] Zn + Cu+2 = Zn+2 + Cu
- 20. Гальванический элемент Два металла и растворы их ионов составляют ячейку, которая может генерировать электри-ческий ток. Zn
- 21. Гальванический элемент Анод - электрод, на котором идет процесс окисления; Катод - электрод, на котором идет
- 22. Гальванический элемент ЭДС = ΔЕ = Еок - Евос Пример: = 0,34 В (окислитель) = -0,76
- 23. Гальванический элемент Элемент Лекланше (Ж.Лекланше, 1865 г.): Электролит – паста с NH4Cl (-)Zn| NH4Cl, ZnCl2 |MnO2
- 24. Гальванический элемент "Щелочные" (Alkaline) Мировое производство 7-9 млрд штук в год Электролит – KOH (-)Zn| KOH
- 25. Гальванический элемент "Литиевые" (-) Li | LiClO4 в пропиленкарбонате | MnO2 (+) Li + MnO2 =
- 26. Аккумуляторы Аккумуляторы – химические источники тока многократного действия. По принципу работы и основным элементам конструкции аккумуляторы
- 27. Аккумуляторы Свинцовый аккумулятор ЭДС мин. 2,1 В; зарядный ток = 1/10 емкости; емкость 3-4 Ач/кг заряд
- 28. Аккумуляторы Щелочные ЭДС мин. 1,1 В; зарядный ток = 1/4 емкости; емкость 3,5-8 Ач/кг Cd (Fe)
- 29. Электролиз
- 30. Определение Электролиз - совокупность процессов, протекающих при пропускании электрического тока через раствор или расплав электролита. Отсюда
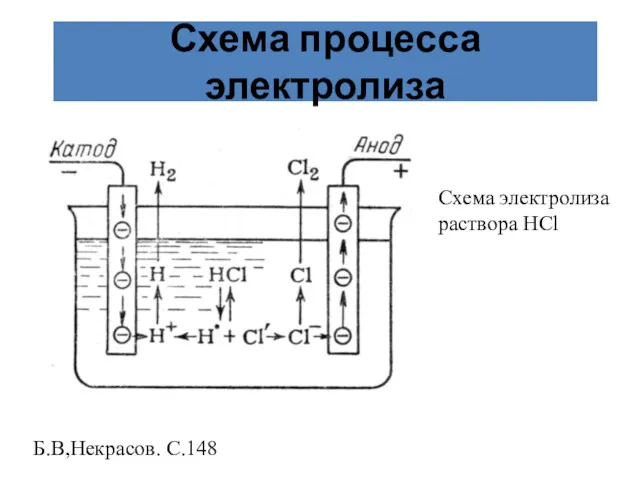
- 31. Схема процесса электролиза Б.В,Некрасов. С.148 Схема электролиза раствора НCl
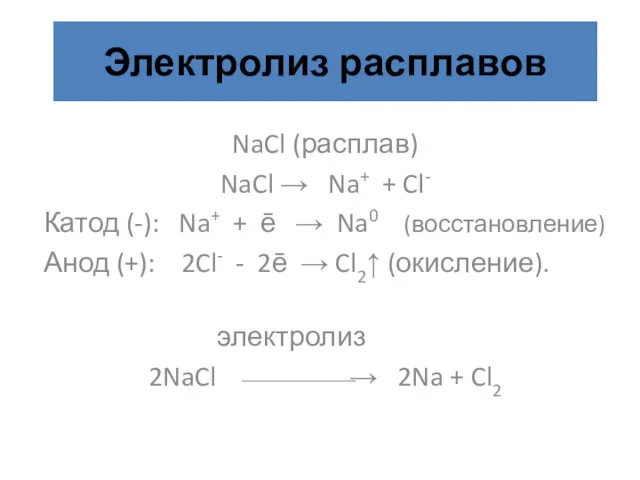
- 32. Электролиз расплавов NaCl (расплав) NaCl → Na+ + Cl- Катод (-): Na+ + ē → Na0
- 33. Электролиз растворов Ход электролиза зависит: от соотношения величин Е0 ионов электролита, ионов Н+ и ОН-, молекул
- 34. Электролиз растворов На катоде восстанавливаются окисленные формы электрохимических систем с наибольшей величиной Е0; на аноде -
- 35. Катодные процессы Если металл стоит в ряду напряжений левее алюминия (включительно), то на катоде восстанавливаются ионы
- 36. Анодные процессы I. На растворимом аноде (медь, никель) происходит окисление материала анода, и металл переходит в
- 37. Электролиз растворов Конкурирующие процессы: На аноде (+): 2Н2О→О2+4Н++4ē (рН ≤ 7) =1,23 В; 4ОН-→О2+2Н2О+4ē(рН >7) =
- 38. Электролиз растворов Электролиз раствора KI (рН = 7) KI ⮀ K+ + I- Н2О ⮀ Н+
- 39. Электролиз водных растворов электролитов. Электролиз раствора хлорида магния: MgCl2 ⇔ Mg2+ +2Cl- (-)К: 2Н2О + 2е
- 40. Электролиз водных растворов электролитов. Электролиз раствора сульфата железа: FeSO4 ⇔ Fe2+ + SO42- (-)К: Fe2+ +
- 42. Скачать презентацию














![Гальванический элемент Схема гальванического элемента [Н.С.Ахметов. С.223] Zn + Cu+2 = Zn+2 + Cu](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/146731/slide-18.jpg)



















 Спирты: общая характеристика
Спирты: общая характеристика Аминокислоты. Свойства
Аминокислоты. Свойства Кислотность органических соединений. Типы химических реакций
Кислотность органических соединений. Типы химических реакций Викторина Своя игра. Периодический закон и периодическая система химических элементов Д.И. Менделеева
Викторина Своя игра. Периодический закон и периодическая система химических элементов Д.И. Менделеева Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Единство химической организации живых организмов
Единство химической организации живых организмов Алкены. Строение, изомерия, номенклатура
Алкены. Строение, изомерия, номенклатура Координационные комплексные соединения
Координационные комплексные соединения Установка гидрокрекинга
Установка гидрокрекинга Алкены. Ненасыщенные углеводороды, непредельные углеводороды, этиленовые углеводороды. Олефины (10 класс)
Алкены. Ненасыщенные углеводороды, непредельные углеводороды, этиленовые углеводороды. Олефины (10 класс) Загальні відомості про хімічну зброю. Кодування засобів застосування хімічних боєприпасів
Загальні відомості про хімічну зброю. Кодування засобів застосування хімічних боєприпасів Коллигативные свойства растворов
Коллигативные свойства растворов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Мембранное материаловедение. Топливные элементы
Мембранное материаловедение. Топливные элементы Межмолекулярные силы (силы Ван дер Ваальса)
Межмолекулярные силы (силы Ван дер Ваальса) Химическая реакция. Признаки химической реакции. Химические и нехимические явления
Химическая реакция. Признаки химической реакции. Химические и нехимические явления Карбоновые кислоты и их гетерофункциональные производные
Карбоновые кислоты и их гетерофункциональные производные Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс
Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс Гидрирование пиробензина
Гидрирование пиробензина Электролиз – ОВ процесс
Электролиз – ОВ процесс Аминокислоты 2
Аминокислоты 2 Оксиды, их классификация и свойства
Оксиды, их классификация и свойства Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для
Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для Химическая термодинамика. Термохимия. Лекция 6
Химическая термодинамика. Термохимия. Лекция 6 Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) Сағыз пайдалы ма, әлде зиян ба?
Сағыз пайдалы ма, әлде зиян ба? Оксиды неметаллов
Оксиды неметаллов Химическое равновесие. Смещение химического равновесия
Химическое равновесие. Смещение химического равновесия