Содержание
- 2. 3. Кислотность органических соединений Кислотно-основные свойства органических веществ рассматривают, основываясь на положениях протонной теории кислот и
- 3. Основные положения теории: Кислота – частица (молекула или ион), отдающая протон в данной реакции, т.е. донор
- 4. 2. Основание – частица (молекула или ион), присоединяющая протон в данной реакии, т.е. акцептор H+.
- 5. Протолитическая теория кислот и оснований Основание – частица (молекула или ион), присоединяющая протон в данной реакии,
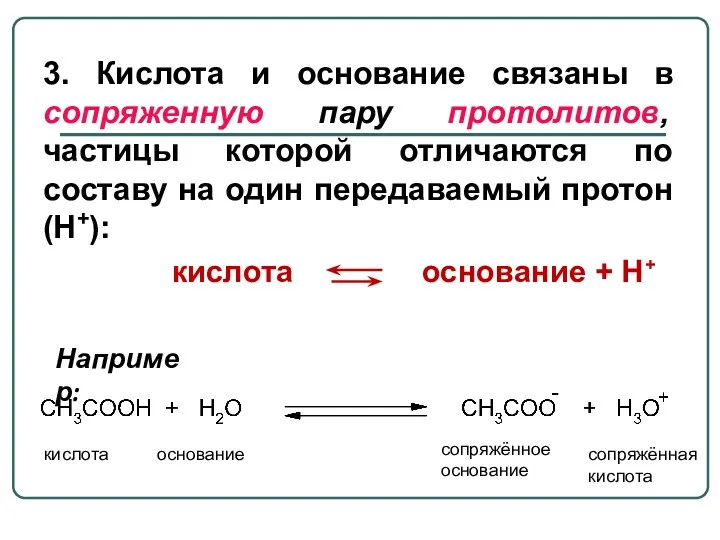
- 6. 3. Кислота и основание связаны в сопряженную пару протолитов, частицы которой отличаются по составу на один
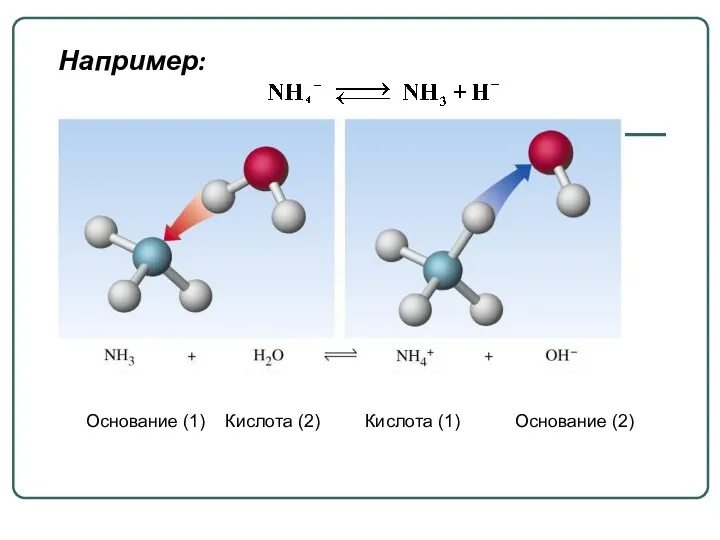
- 7. Основание (1) Кислота (2) Кислота (1) Основание (2) Например:
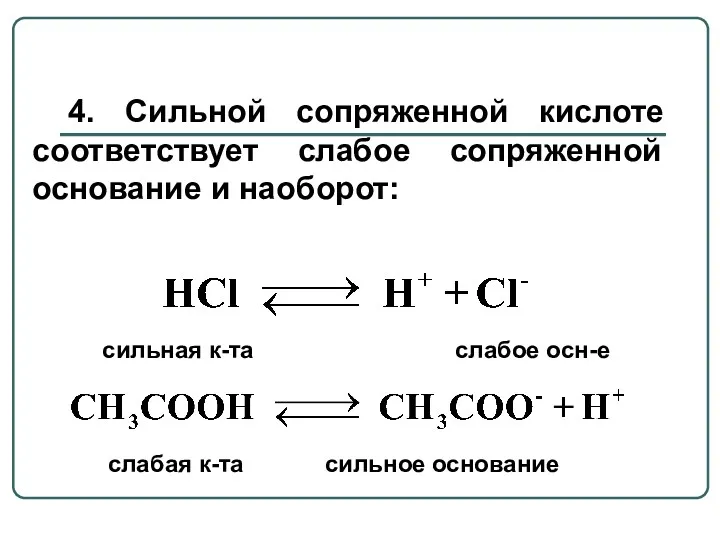
- 8. 4. Сильной сопряженной кислоте соответствует слабое сопряженной основание и наоборот: сильная к-та слабое осн-е слабая к-та
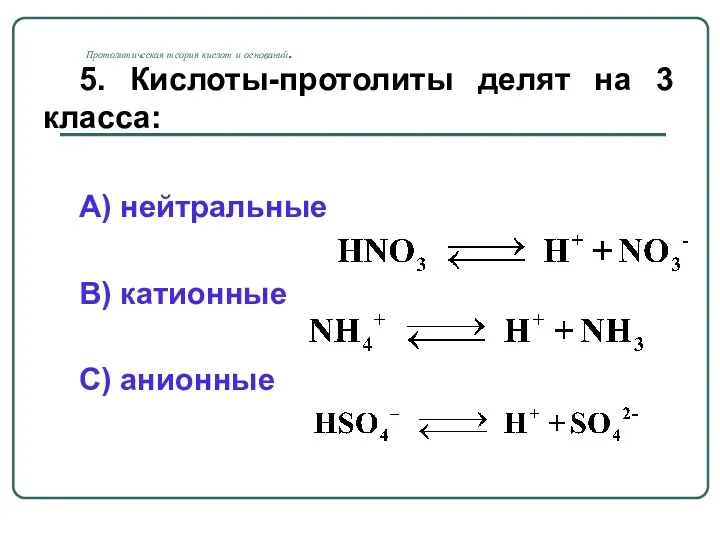
- 9. Протолитическая теория кислот и оснований. 5. Кислоты-протолиты делят на 3 класса: А) нейтральные В) катионные С)
- 10. Основания-протолиты также делятся на 3 класса: Нейтральные NH3 + Н+ NH4+ B) Катионные FeOH+ C) Анионные
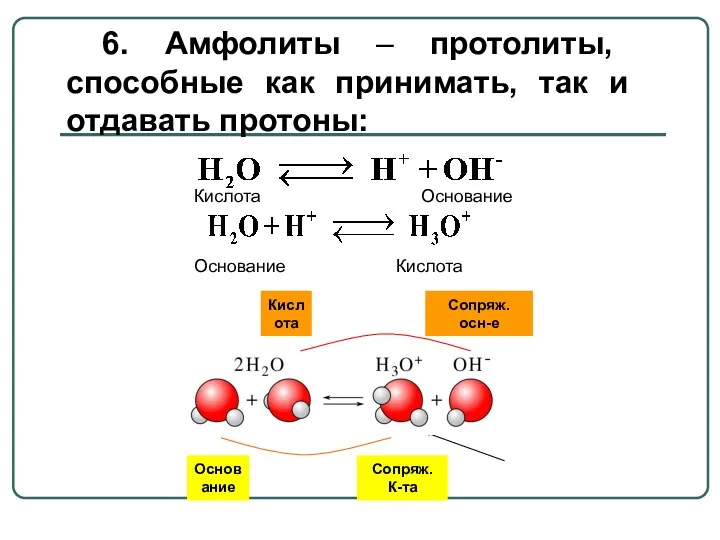
- 11. Кислота Сопряж. осн-е Основание Сопряж. К-та 6. Амфолиты – протолиты, способные как принимать, так и отдавать
- 12. 7. Количественно сила кислот-протолитов оценивается величиной константы кислотности (Ка). Ка характеризует момент химического равновесия в процессе
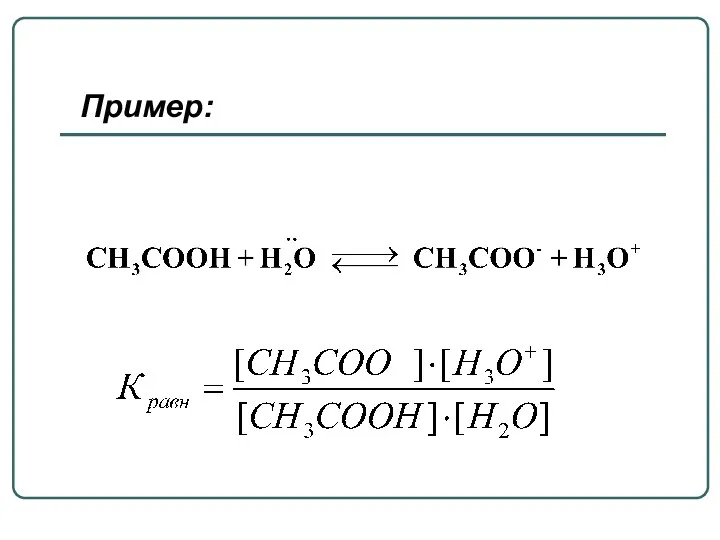
- 13. Пример:
- 14. Таким образом, чем выше концентрация сопряженных частиц продуктов протонного переноса, тем больше значение Ка, а значит
- 15. На практике используют показатель константы кислотности (pKa): Чем меньше значение pKa, тем сильнее кислота.
- 16. Кислотным центром называется элемент (С, S, O, N) и связанный с ним атом водорода. Органические кислоты
- 17. Формулы и названия веществ рКа 18 С2Н5ОН этанол 10,5 С2Н5SH этантиол 30 С2Н5NH2 этанамин 9,9 С6Н5ОН
- 18. На стабильность аниона оказывают влияние следующие факторы: 1. Природа элемента в кислотном центре. а) электроотрицательность элемента
- 19. кислород более электроотрицательный элемент связь О-Н более полярна, чем N-H, что способствует более легкой отщепляемости в
- 20. б) поляризуемость элемента в кислотном центре. Сравним кислотные свойства веществ с одинаковыми радикалами: СН3–СН2 –ОН (рКа=18)
- 21. Благодаря большему радиусу и более высокой поляризуемости атома серы, отрицательный заряд в анионе СН3–СН2–S- (меркаптид-ион) делокализован
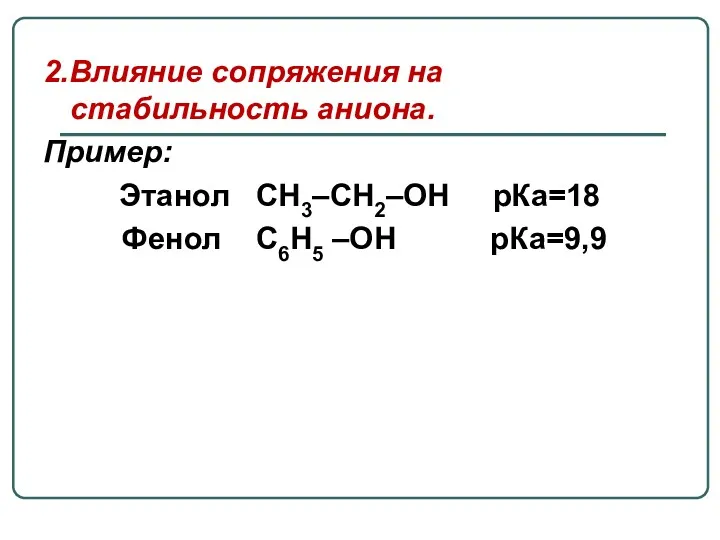
- 22. 2.Влияние сопряжения на стабильность аниона. Пример: Этанол СН3–СН2–ОН рКа=18 Фенол С6Н5 –ОН рКа=9,9
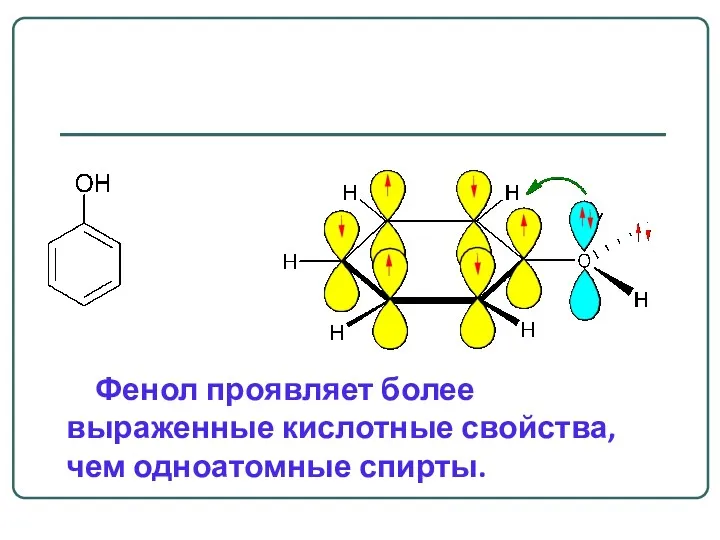
- 23. В молекуле фенола под влиянием ЭД-заместителя электронная плотность смещена от заместителя и делокализована по ароматическому кольцу.
- 24. Фенол проявляет более выраженные кислотные свойства, чем одноатомные спирты.
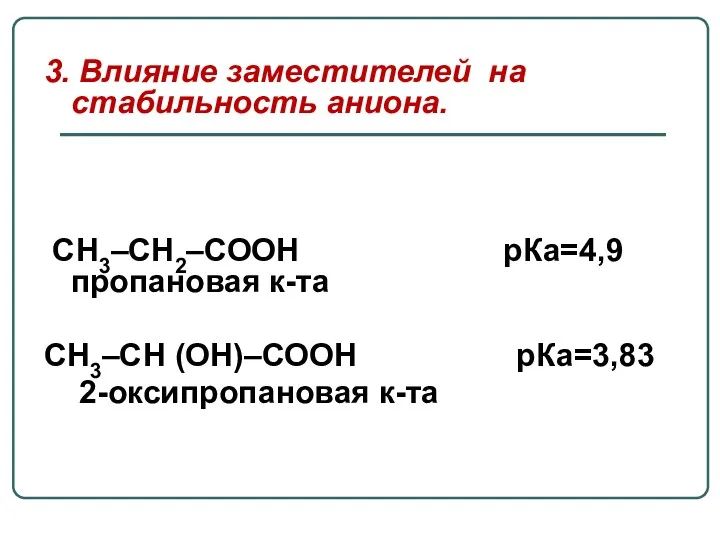
- 25. 3. Влияние заместителей на стабильность аниона. СН3–СН2–СООН рКа=4,9 пропановая к-та СН3–СН (ОН)–СООН рКа=3,83 2-оксипропановая к-та
- 26. Наличие в радикале кислоты ЭА заместителя –ОН-группы способствует делокализации отрицательного заряда в лактат-анионе, что повышает его
- 27. 4. Влияние растворителя на стабильность аниона. Чем меньше радикал аниона, тем он более гидратирован и стабилен.
- 29. Скачать презентацию















 Сравнительная характеристика галогенов
Сравнительная характеристика галогенов Полиэлектролиты. (Тема 3)
Полиэлектролиты. (Тема 3) Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу Материаловедение. Физические и химические структуры материалов
Материаловедение. Физические и химические структуры материалов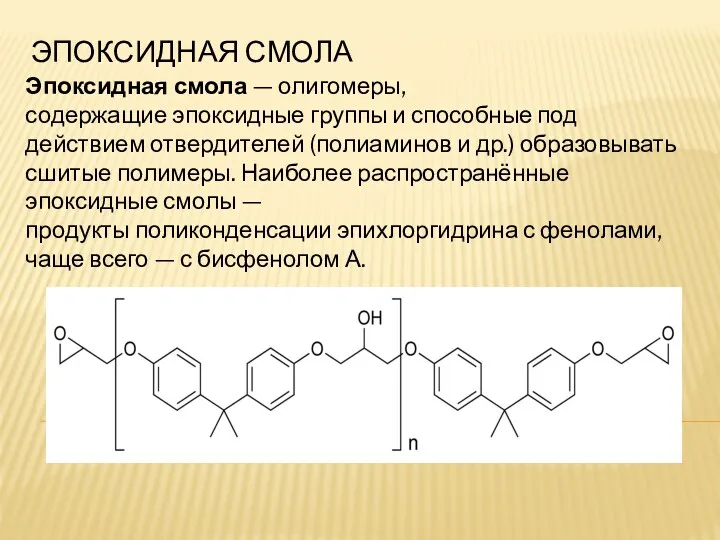 Эпоксидная смола
Эпоксидная смола Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины
Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины Щёлочноземельные металлы
Щёлочноземельные металлы Спирты. Определение. Классификация
Спирты. Определение. Классификация Кислотно-основное титрование
Кислотно-основное титрование Химический элемент и вещество
Химический элемент и вещество Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні
Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні Нуклеиновые кислоты, их структурные компоненты
Нуклеиновые кислоты, их структурные компоненты Презентации-задания к урокам химии по различным темам
Презентации-задания к урокам химии по различным темам Фосфор и его соединения
Фосфор и его соединения Алюминий на кухне - опасный враг или верный помощник?
Алюминий на кухне - опасный враг или верный помощник?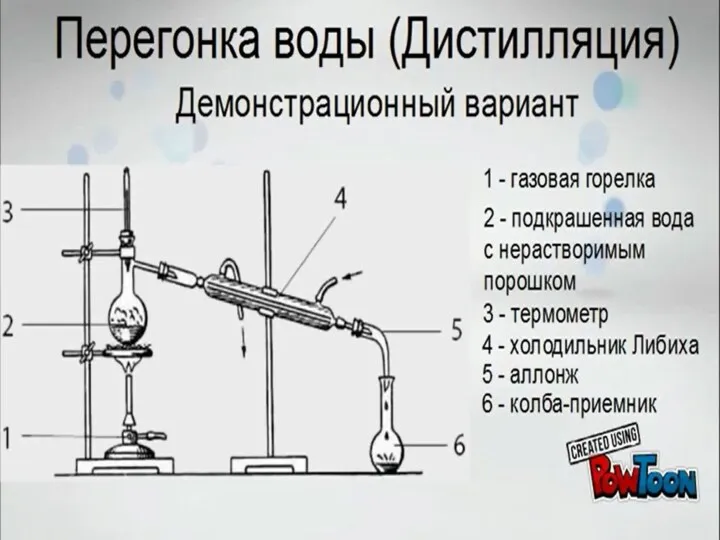 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Нано-порошки. Способы получения нано-порошков
Нано-порошки. Способы получения нано-порошков Атом - сложная частица
Атом - сложная частица Горные породы
Горные породы Алкины. Ацетилен.
Алкины. Ацетилен. Спектрофометрия
Спектрофометрия Воздух, которым мы дышим
Воздух, которым мы дышим Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Щелочные металлы
Щелочные металлы Качественные реакции
Качественные реакции Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ