Понятие о катаболизме и анаболизме. Основы питания. Незаменимые пищевые факторы. Биоэнергетика. Структурная организация ЦПЭ презентация
Содержание
- 2. Определение Метаболизм - совокупность всех биохимических реакций в организме. Вещества, участвующие в метаболизме, называются метаболитами Подавляющее
- 3. Функции клеточного метаболизма Снабжение клеток химической энергией (источник -расщепление питательных веществ, фотосинтез) Превращение молекул пищевых веществ
- 4. Все живые организмы по форме усвояемого углерода делятса на: Автотрофы («сами себя питающие»)- усваивают СО2 воздуха
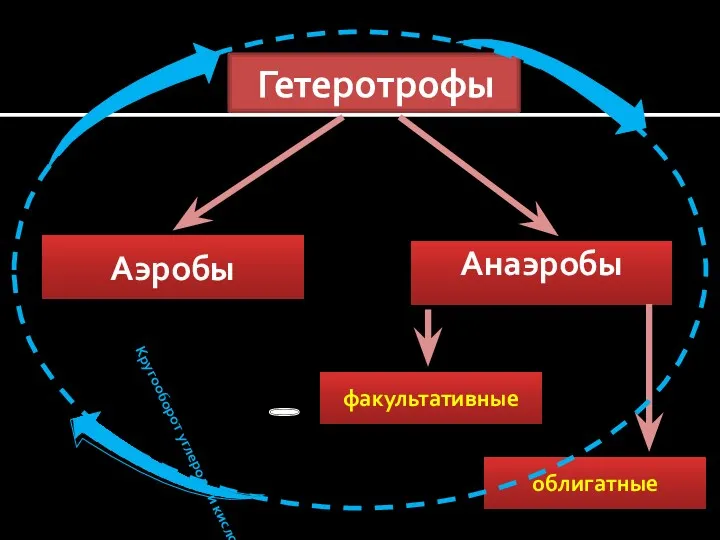
- 5. Гетеротрофы Аэробы Анаэробы факультативные облигатные
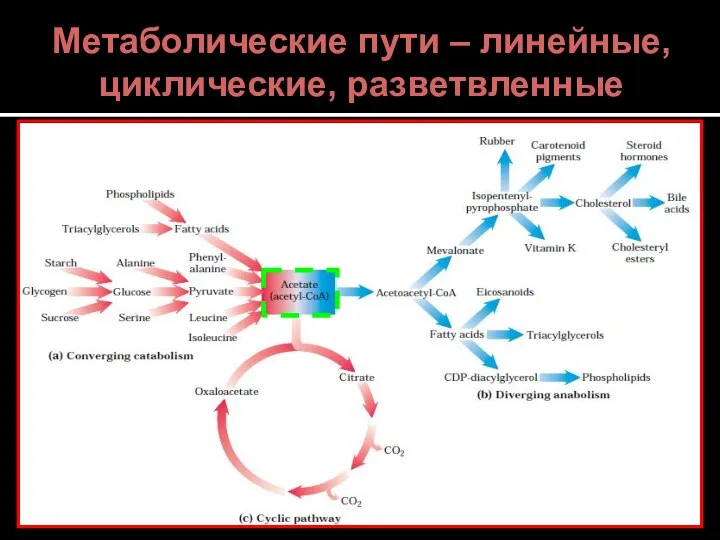
- 7. Метаболические пути – линейные, циклические, разветвленные
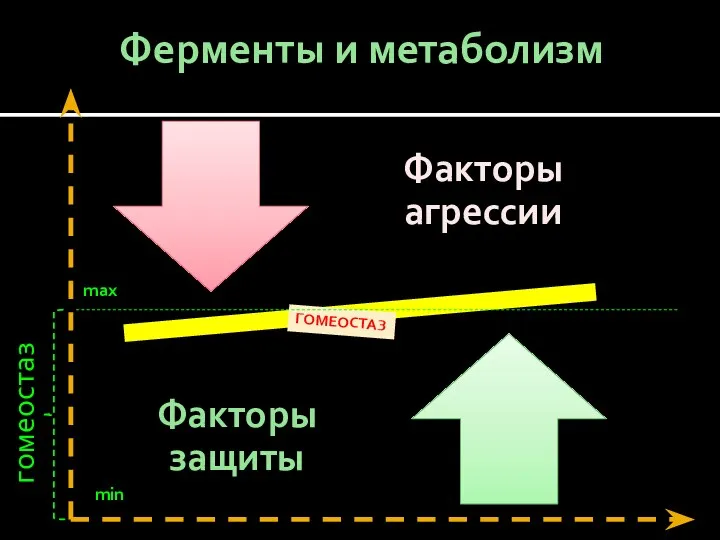
- 8. Ферменты и метаболизм ГОМЕОСТАЗ max min гомеостаз
- 9. Регуляция метаболических путей (по Ленинджеру) Быстрое реагирование, связанное с действием аллостерических ферментов, каталитическая активность которых может
- 10. Катаболизм и анаболизм Промежуточный метаболизм складывается из 2-х составляющих: Катаболизм (расщепление сложных органических соединений до более
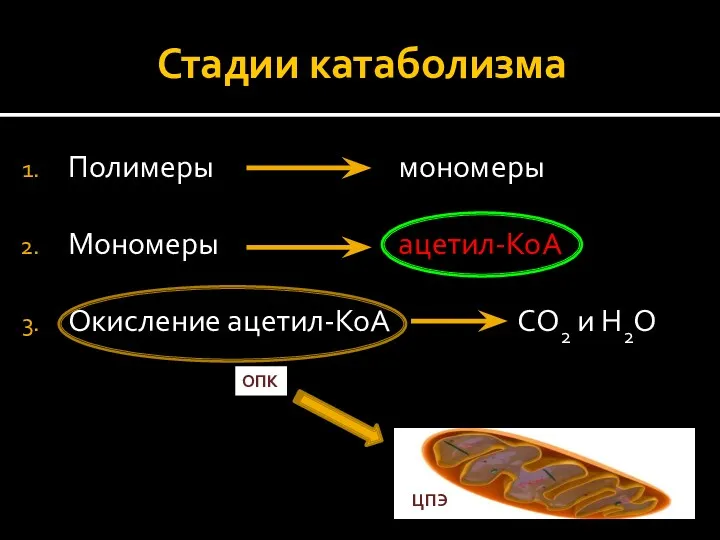
- 11. Стадии катаболизма Полимеры мономеры Мономеры ацетил-КоА Окисление ацетил-КоА СО2 и Н2О ЦПЭ ОПК
- 12. СТАДИИ АНАБОЛИЗМА Третья стадия катаболизма является первой стадией анаболизма. Анаболические реакции регулируются независимо от катаболических, т.к.
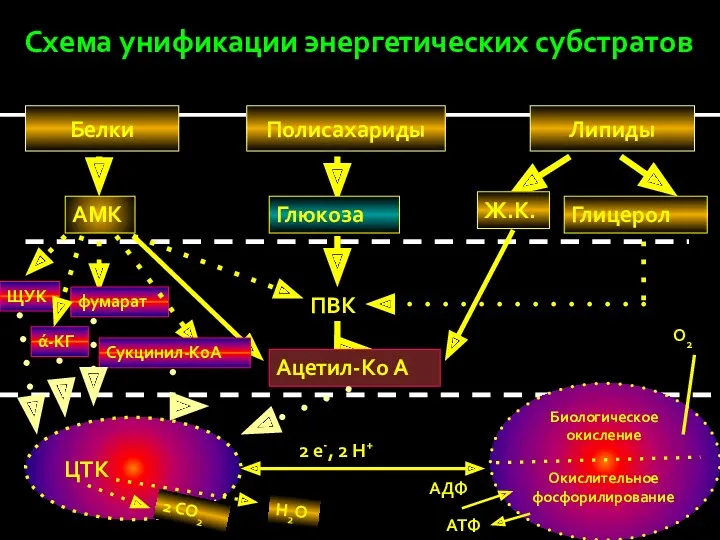
- 13. Схема унификации энергетических субстратов Белки Полисахариды Липиды Глюкоза Ж.К. Глицерол АМК ПВК Ацетил-Ко А ЩУК фумарат
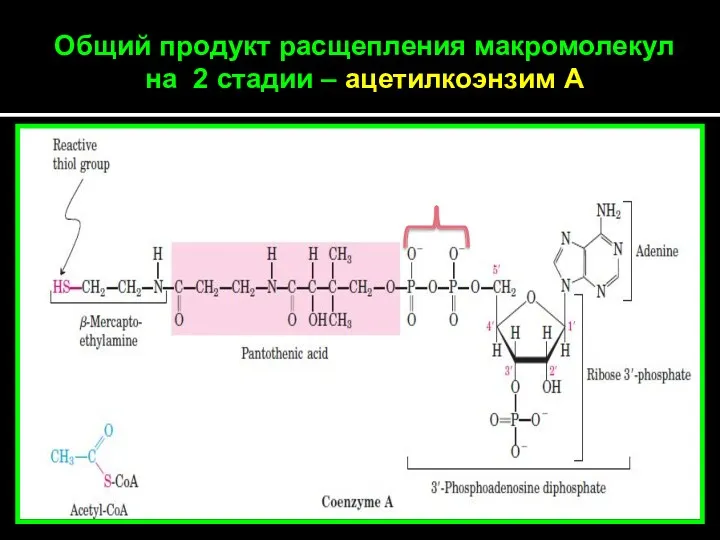
- 14. Общий продукт расщепления макромолекул на 2 стадии – ацетилкоэнзим А
- 15. Типы окисляемых субстратов Субстраты 1 типа (углеводородные) – сукцинат, ацетил-КоА. ∆G = 150 кДж/моль. Это меньше,
- 16. История развития учения о биологическом окислении В конце XVIII века А.Лавуазье показал, что горение и окисление
- 17. 1 теория – А.Н. Баха «перекисная», или «теория активации кислорода» О Е + О2 Е АО2
- 18. Современная теория биологического окисления Путем отнятия водорода от окисляемого субстрата – митохондриальное окисление и внемитохондриальное окисление
- 19. Пути потребления кислорода Вещество окисляется, если теряет электроны и протоны (дегидрирование), или присоединяет кислород. Противоположные превращения
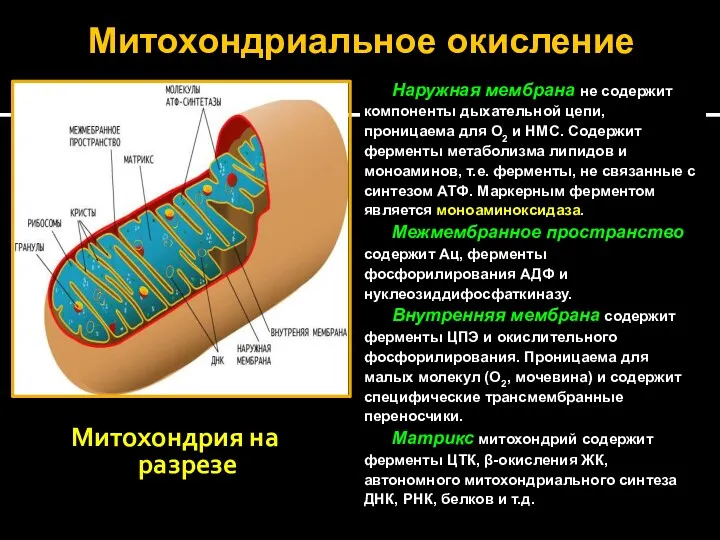
- 20. Митохондриальное окисление Митохондрия на разрезе Наружная мембрана не содержит компоненты дыхательной цепи, проницаема для О2 и
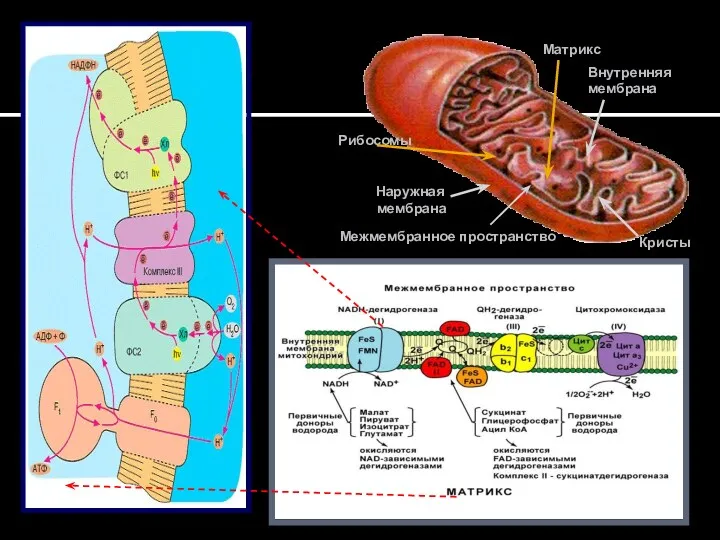
- 21. Наружная мембрана Внутренняя мембрана Кристы Межмембранное пространство Рибосомы Матрикс
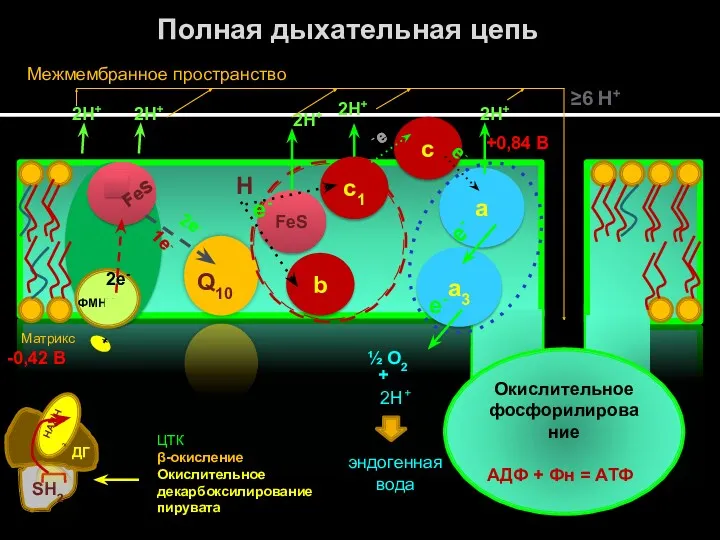
- 23. Окислительное фосфорилирование АДФ + Фн = АТФ SH2 НАДН2 ДГ ФМНН2 -е FeS 2е- 1е- Q10
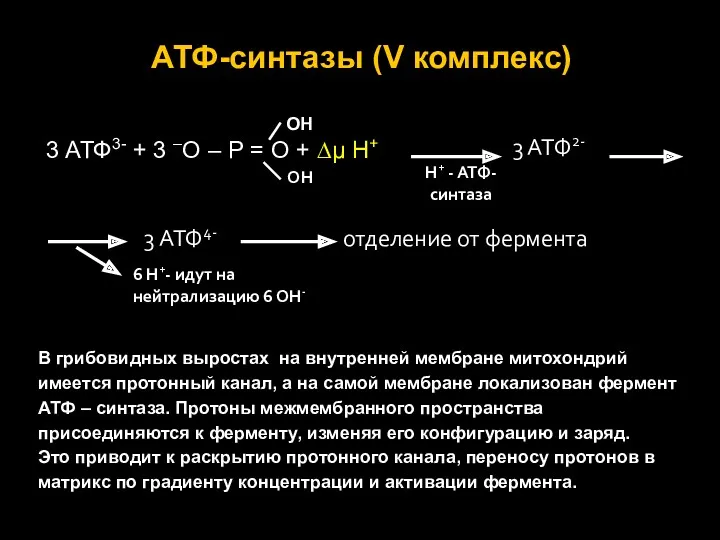
- 24. АТФ-синтазы (V комплекс) ОН 3 АТФ3- + 3 –О – Р = О + ∆μ Н+
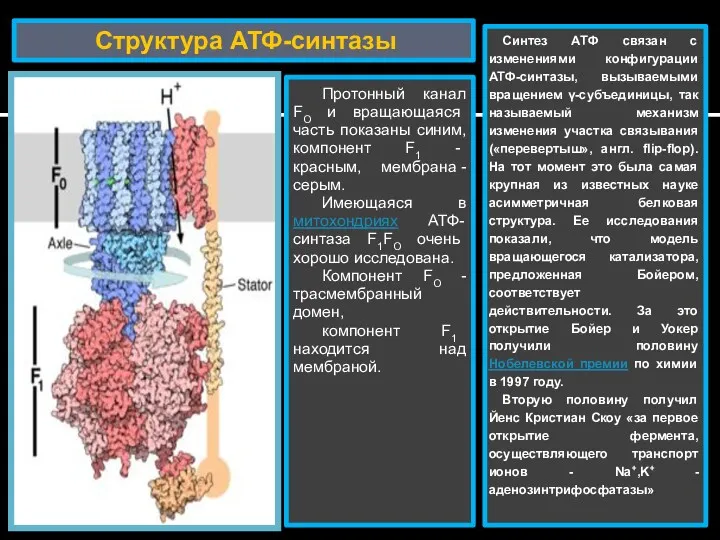
- 25. Структура АТФ-синтазы Протонный канал FO и вращающаяся часть показаны синим, компонент F1 - красным, мембрана -
- 27. Полная дыхательная цепь Комплекс I – НАДН-КоQ (убихинон) – оксидоредуктаза, обеспечивает передачу е- от НАДН+Н+ к
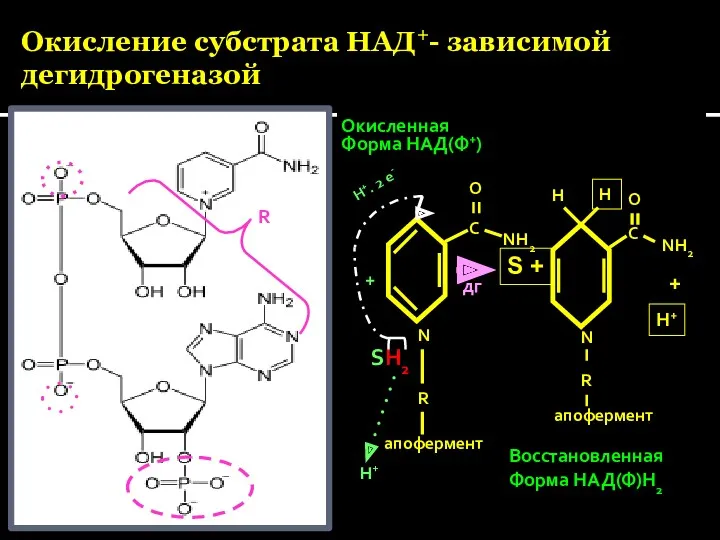
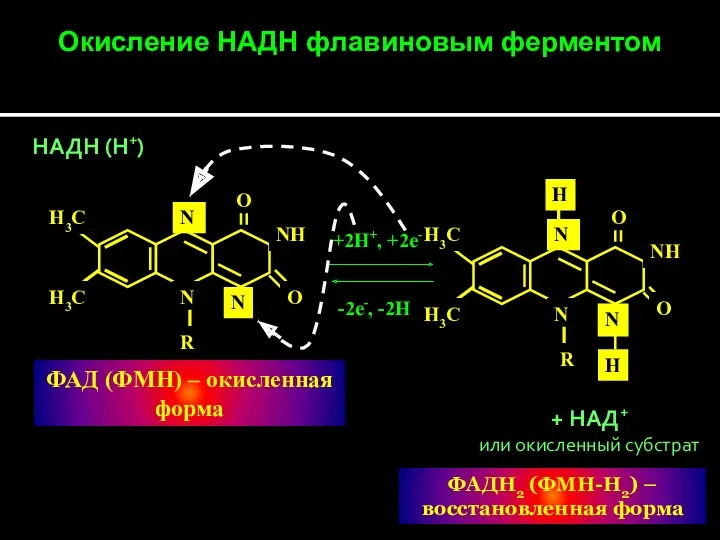
- 28. Окисление субстрата НАД+- зависимой дегидрогеназой Окисленная Форма НАД(Ф+) SH2 R N R апофермент С О NH2
- 29. Н3С Н3С N R N N O NH O Н3С Н3С N R N N O
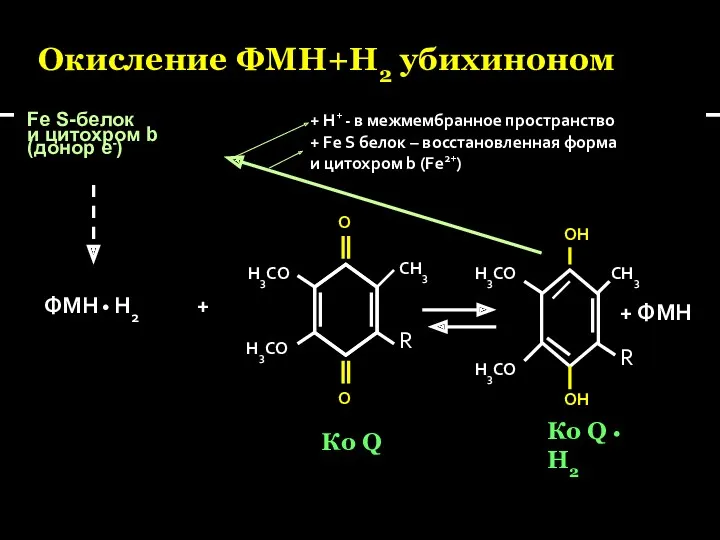
- 30. Окисление ФМН+Н2 убихиноном Fe S-белок и цитохром b (донор е-) О О СН3 R Н3СО Н3СО
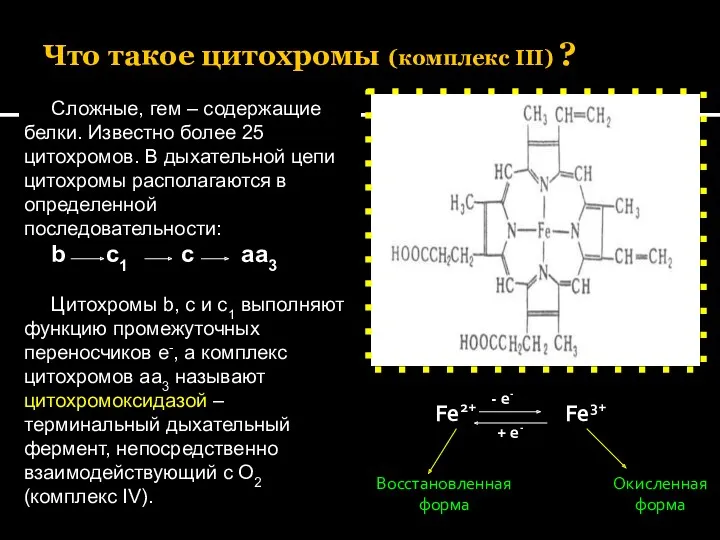
- 31. Что такое цитохромы (комплекс III) ? Сложные, гем – содержащие белки. Известно более 25 цитохромов. В
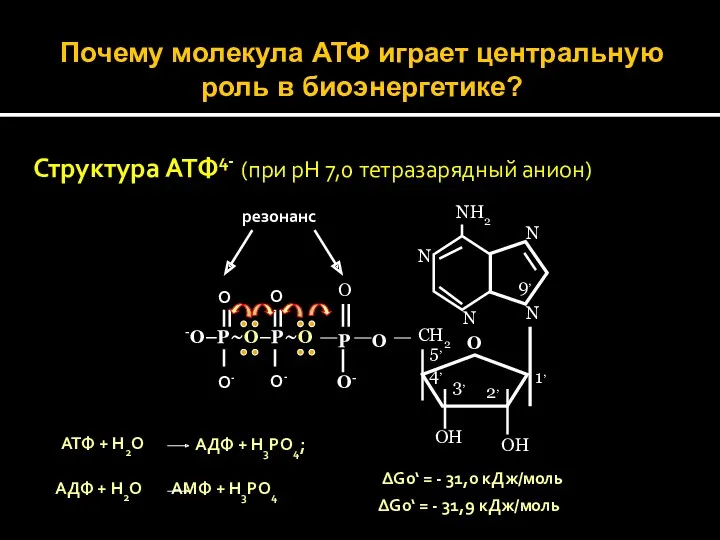
- 32. Почему молекула АТФ играет центральную роль в биоэнергетике? Структура АТФ4- (при рН 7,0 тетразарядный анион) N
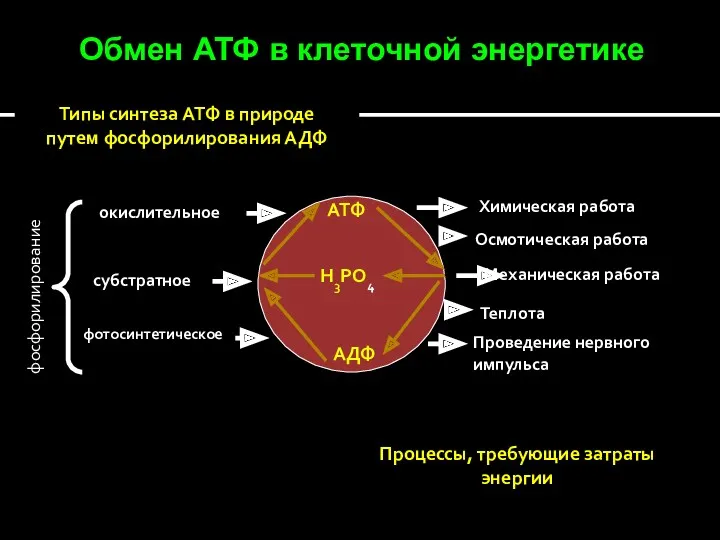
- 33. Обмен АТФ в клеточной энергетике АТФ Н3РО4 АДФ фосфорилирование окислительное субстратное фотосинтетическое Химическая работа Осмотическая работа
- 34. Окислительное фосфорилирование – это синтез АТФ из АДФ и неорганического фосфата, сопряженный с переносом протонов и
- 36. Скачать презентацию
















 Совы. Интересные факты о совах
Совы. Интересные факты о совах Многообразие простейших. Корненожки, Радиолярии, Солнечники, Споровики
Многообразие простейших. Корненожки, Радиолярии, Солнечники, Споровики Класс Млекопитающие, или Звери
Класс Млекопитающие, или Звери Семейство кошачьих. Тигр
Семейство кошачьих. Тигр Методы исследования в биологии
Методы исследования в биологии Иммуноферментный анализ (ИФА)
Иммуноферментный анализ (ИФА) Биологическая игра Угадай растение
Биологическая игра Угадай растение Выделительная система
Выделительная система Қос мекенділердің орталық нерв жүйесі мен ішкі қанқасы
Қос мекенділердің орталық нерв жүйесі мен ішкі қанқасы Химические компоненты живых организмов
Химические компоненты живых организмов Физиология продолговатого мозга и моста
Физиология продолговатого мозга и моста Кольчатые черви
Кольчатые черви Деревья. Удивительные факты из жизни деревьев
Деревья. Удивительные факты из жизни деревьев Строение, свойства и функции цитоплазмы
Строение, свойства и функции цитоплазмы Мир динозавров
Мир динозавров Предмет психогенетики
Предмет психогенетики Субтропические плоды
Субтропические плоды Бактерии
Бактерии Рептилії
Рептилії Витамины, витаминоподобные вещества и антивитамины
Витамины, витаминоподобные вещества и антивитамины Нервная система
Нервная система Полезные свойства мёда
Полезные свойства мёда Тип Плоские черви. Особенности организации плоских червей. Плоские черви – паразиты
Тип Плоские черви. Особенности организации плоских червей. Плоские черви – паразиты Еволюція популяцій
Еволюція популяцій Зоология. Безпозвоночные. Членистоногие
Зоология. Безпозвоночные. Членистоногие Клеточное строение стебля
Клеточное строение стебля Насекомые
Насекомые Высшая нервная деятельность человека
Высшая нервная деятельность человека