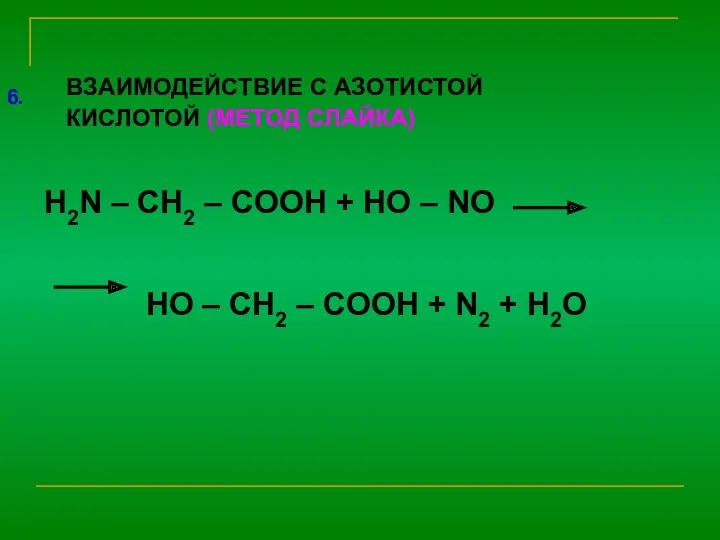
Свойства:
1) В растворе находятся в виде биполярного иона
N+H3 –
CH – COOH N+H3 – CH – COO - NH2 – CH – COO-
| | |
R R R
2) С кислотами
NH2 – CH2 – COOH + НС| → [NH3 – CH2 – COOH ] С| хлорид
как основание
3) С основаниями
NH2 – CH2 – COOH + Na OH → NH2 – CH2 – COONa + H2O
как кислота
Физические : растворимы в воде, сладкие, безвкусные, горькие
( зависит от радикала)
Вывод : органические амфотерные соединения
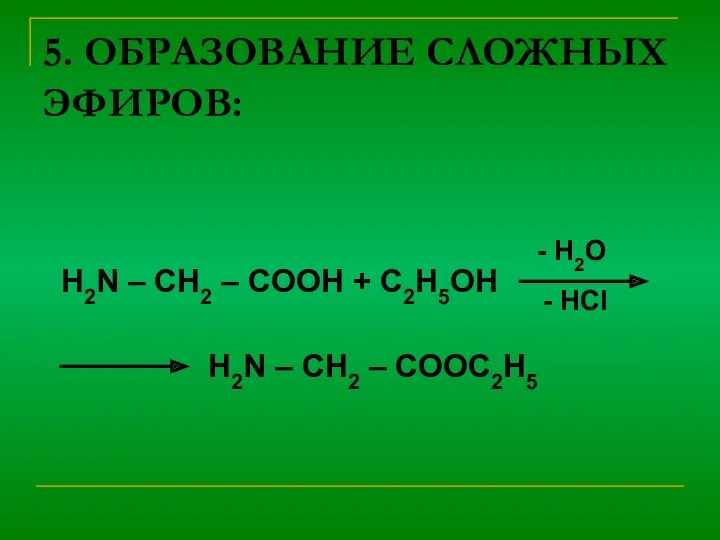
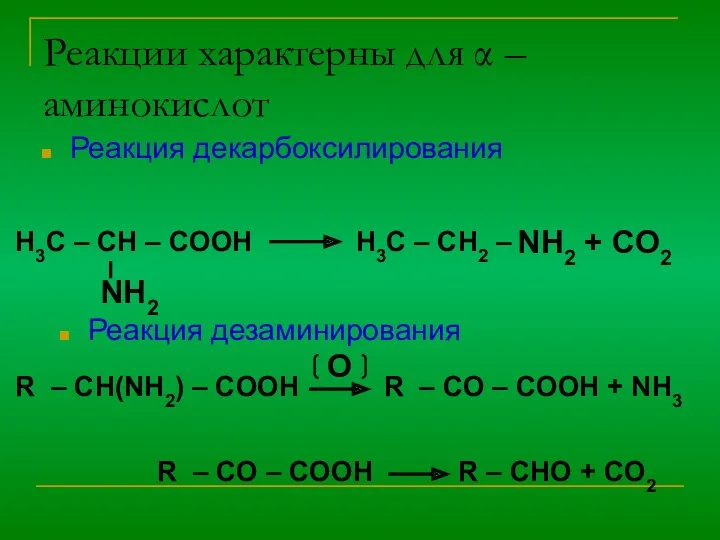
4) Специфическое - взаимодействие между собой
NH2 – CH2 – COOH + НNH – CH2 – COOH → NH2 – CH2 – CO- NH – CH2 –COOH
пептидная
связь
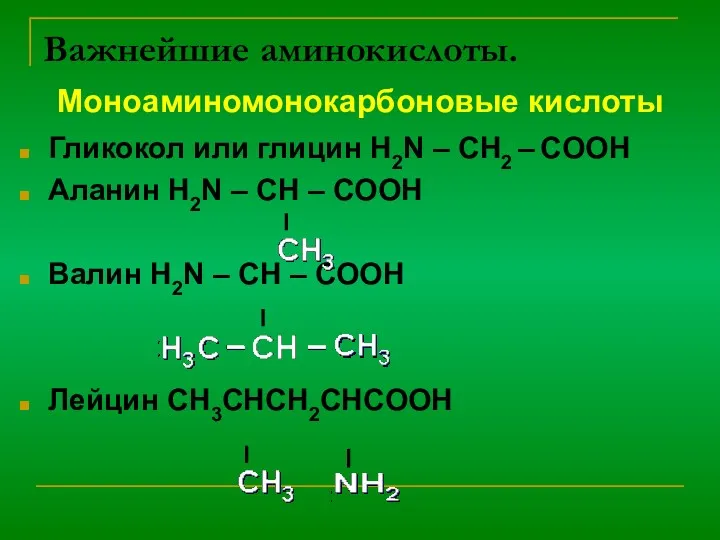
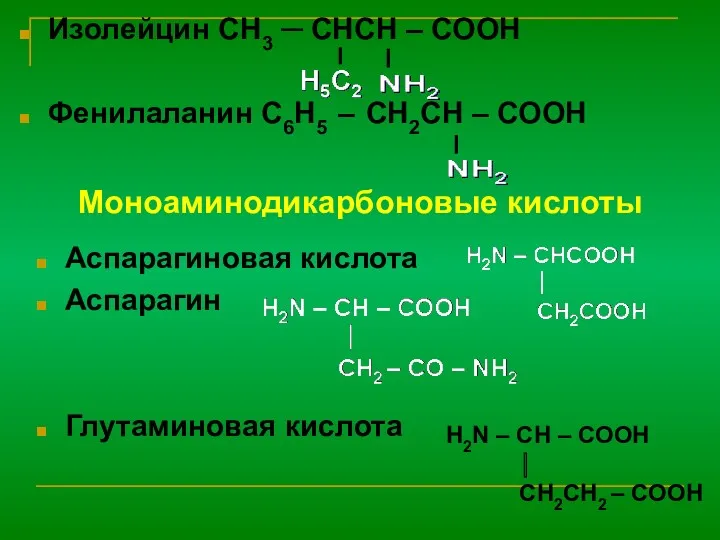
α-аминокислоты – элементарные частицы природных полимеров- белков
Биполярный ион
Химические :



 Сахар - вред или польза?
Сахар - вред или польза? Evolution of Isoconversional Methods
Evolution of Isoconversional Methods Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Простые вещества металлы
Простые вещества металлы Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Предельные одноатомные спирты
Предельные одноатомные спирты Геохимическая классификация элементов
Геохимическая классификация элементов Химические реакции. Реакции разложения
Химические реакции. Реакции разложения Магній. Знаходження в періодичній системі і основні характеристики
Магній. Знаходження в періодичній системі і основні характеристики Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций
Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Пестициды. Лекция
Пестициды. Лекция Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Анионы. Группы анионов
Анионы. Группы анионов Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Лигандообменные равновесия и процессы. Строение комплексных соединений
Лигандообменные равновесия и процессы. Строение комплексных соединений Стронций
Стронций Классификация химических реакций
Классификация химических реакций 20231012_metally.fizicheskie_svoystva
20231012_metally.fizicheskie_svoystva Матеріальний баланс процесу горіння
Матеріальний баланс процесу горіння Химические аспекты метаболизма лекарственных препаратов
Химические аспекты метаболизма лекарственных препаратов Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Щелочноземельные металлы
Щелочноземельные металлы Электролитическая диссоциация
Электролитическая диссоциация Алкани, насичені вуглеводні
Алкани, насичені вуглеводні Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Количество вещества. 8 класс
Количество вещества. 8 класс Химические волокна (7 класс)
Химические волокна (7 класс)