Содержание
- 2. * Комплексными называют сложные частицы, образованные из реально существующих более простых, способные к самостоятельному существованию как
- 3. * Fe(CN)3 + 3KCN → K3[Fe(CN)6] CuSO4+5H2O→ [Cu(H2O)4]SO4·H2O NiCl2+6H2O→[Ni(H2O)6]Cl2
- 4. * Комплексными (координационными) соединениями называют вещества, молекулы которых состоят из центрального атома (или иона) М, непосредственно
- 5. * 1. М + L = внутренняя сфера (обозначается [ ]) 2. ионы за пределами [
- 6. * [Ni(NH3)6]Cl2 K4[Fe(CN)6] [Cr(CO)6] Внеш. сферы нет
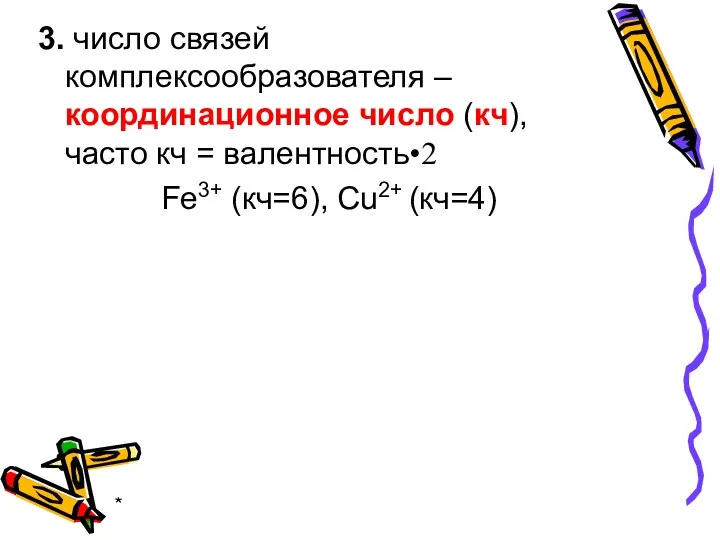
- 7. * 3. число связей комплексообразователя – координационное число (кч), часто кч = валентность•2 Fe3+ (кч=6), Cu2+
- 8. * 4. число связей лиганда – дентантность - монодентантные (H2O:, CN–, :NH3, SCN–, Сl–, Br –,
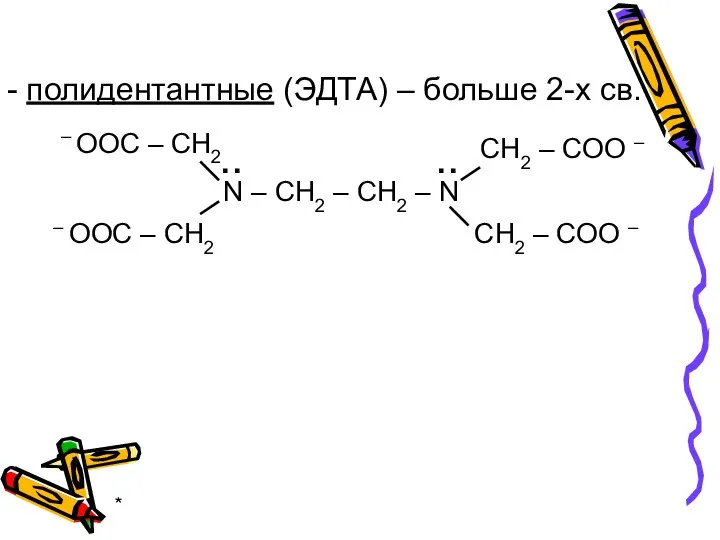
- 9. * - полидентантные (ЭДТА) – больше 2-х св.
- 10. * [Al(OH)4]- Механизм образования донорно-акцепторных связей: Al 3+ sp3 гибридизация
- 11. * как правило, лиганды – доноры электронов, комплексообразователь – акцептор, но есть исключение [HgI4]2- : ион
- 12. * (OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0
- 13. * На способность к комплексообразованию влияют: 1. Природа комплексообразователя (чем больше радиус М и больше число
- 14. * 2. Природа лиганда (чем больше поляризуемость лиганда, т. е. способность трансформировать свои электронные оболочки под
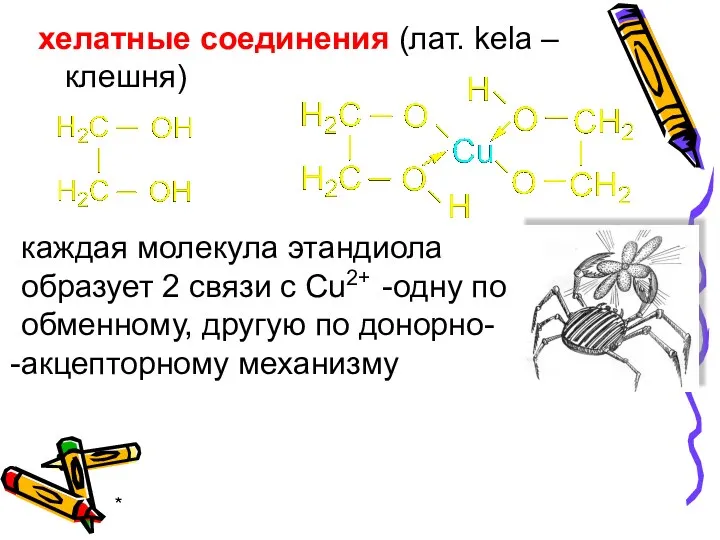
- 15. * хелатные соединения (лат. kela – клешня) каждая молекула этандиола образует 2 связи с Cu2+ -одну
- 16. * НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5- 6- ди- три- тетра- пента- гекса- ЧИСЛИТЕЛЬНЫЕ:
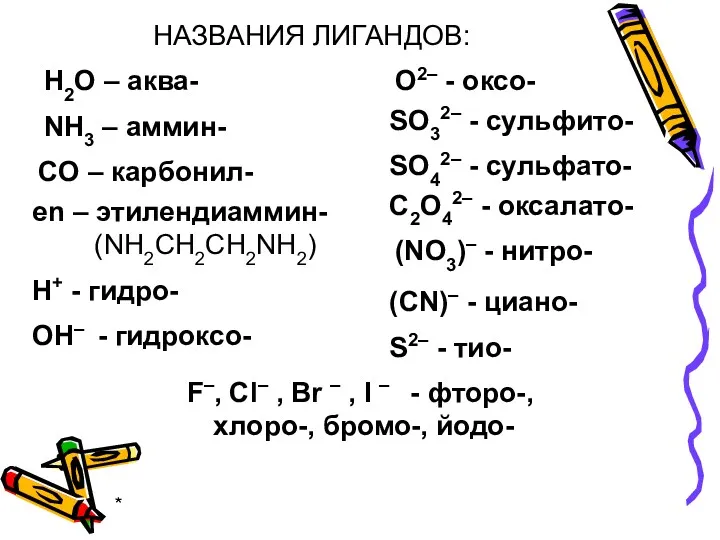
- 17. * НАЗВАНИЯ ЛИГАНДОВ: H2O – аква- NH3 – аммин- СO – карбонил- OН– - гидроксо- (СN)–
- 18. * Названия комплексообразователя: - в составе катиона – русское (железо, серебро, никель, медь и т. д.)
- 19. * В названии комплекса: сначала название аниона (одним словом), потом название катиона (одним словом); в названии
- 20. * после названия коплексообразователя указывается его валентность; если разные лиганды, сначала отрицательные, потом нейтральные, потом положительно
- 21. * тетра гидроксо цинкат (II) Na+2 4] (OH)- [Zn+2 натрия [Cu+2 (en)0 3] Cl-2 хлорид этилендиаммин
- 22. * гекса циано феррат (III) K+3 6] (CN)- [Fe3+ калия [Ag+ (NH3)0 2] Cl- хлорид аммин
- 23. * гекса циано феррат (II) K+4 6] (CN)- [Fe2+ калия [Co+3 Сl3 (NH3)3] триаммин трихлоро кобальт
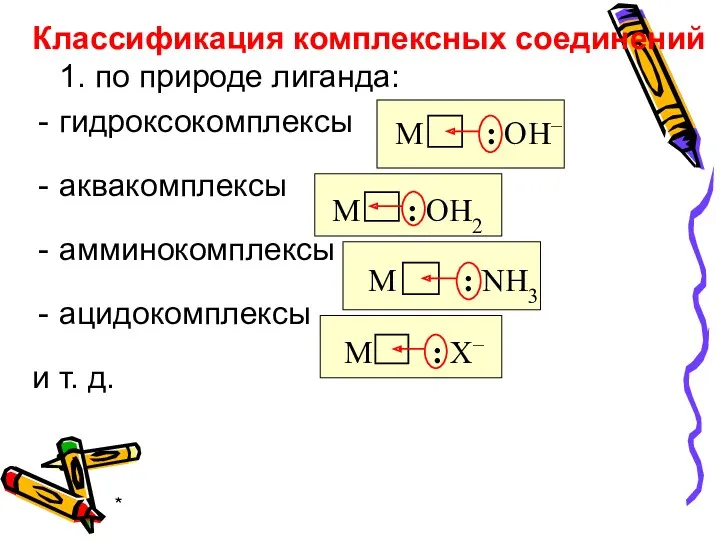
- 24. * Классификация комплексных соединений 1. по природе лиганда: гидроксокомплексы аквакомплексы амминокомплексы ацидокомплексы и т. д.
- 25. * 2. по знаку заряда комплекса катионные [Ag(NH3)2]Cl анионные K3[Fe(CN)6] нейтральные [Pt(NH3)2Cl2] 3. По наличию или
- 26. * 4. По составу и хим. свойствам - кислоты H[AuCl4] - основания [Ag(NH3)2]OH - соли [Co(NH3)6]Cl2
- 27. * Изомерия комплексных соединений геометрическая (цис-транс-изомерия) [Pt(NH3)2Cl2] цис-изомер - противоопухолевая активность трас-изомер - не активен
- 28. * 2. ионизационная [Co(NH3)5Br]SO4 сульфат бромопентаамминкобальта (III) (красно-фиолетовый) [Co(NH3)5SO4]Br бромид сульфатопентаамминкобальта (III) (красный)
- 29. * 3. гидратная [Cr(H2O)6]Cl3 хлорид гексааквахрома (III) (серо-фиолетового цвета) [Cr(H2O)5Сl ]Cl2·H2O гидрат хлорида хлоропентааквахрома (III) (зелёно-фиолетового
- 30. * 4. координационная [Co(NH3)6][Cr(CN)6] гексацианохромат (III) гексаамминкобальта (III) [Cr(NH3)6][Co(CN)6] гексацианокобальтат (III) гексаамминхрома (III)
- 31. * Диссоциация комплексных соединений Первичная (на ионы внешней и внутренней сферы): [Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl–
- 32. * Вторичная (обратимая, ступенчатая): [Ag(NH3)2]+↔ [Ag(NH3)]+ + NH3 [Ag(NH3)]+↔ Ag+ + NH3
- 33. * [Ag(NH3)2]+↔ Ag+ + 2NH3
- 34. * Чем больше КУ (чем меньше КН), тем устойчивее комплекс
- 35. * Многие вещества в организме (АК, белки, НК, витамины, гормоны, порфирины) являются активными лигандами и с
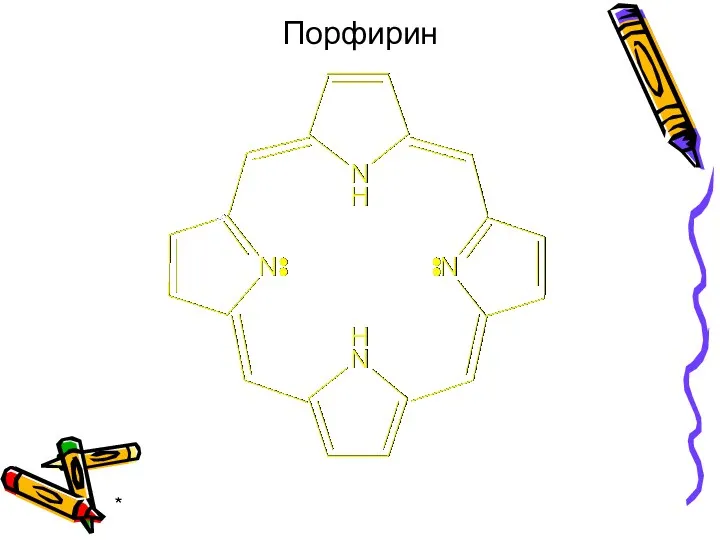
- 36. * Некоторые природные прочные комплексные соединения содержат в качестве хелатообразующего лиганда порфириновые производные. Важнейшим свойством порфиринов
- 37. * Порфирин
- 38. * В результате комплексообразования образуются комплексные соединения порфиринов (металлопорфирины) обладающие многообразными структурными и химическими особенностями, высокой
- 39. * В организмах встречаются комплексы, в которых некоторые атомы Н в порфине замещены на метильные и
- 40. * В составе гемоглобина, миоглобина, цитохромов, каталазы и пероксидазы порфирины выступают в виде комплексов с Fe2+
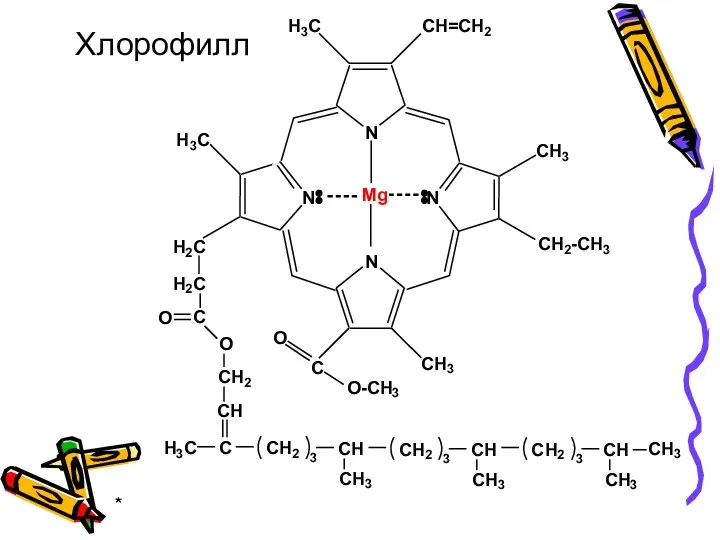
- 41. * Хлорофилл
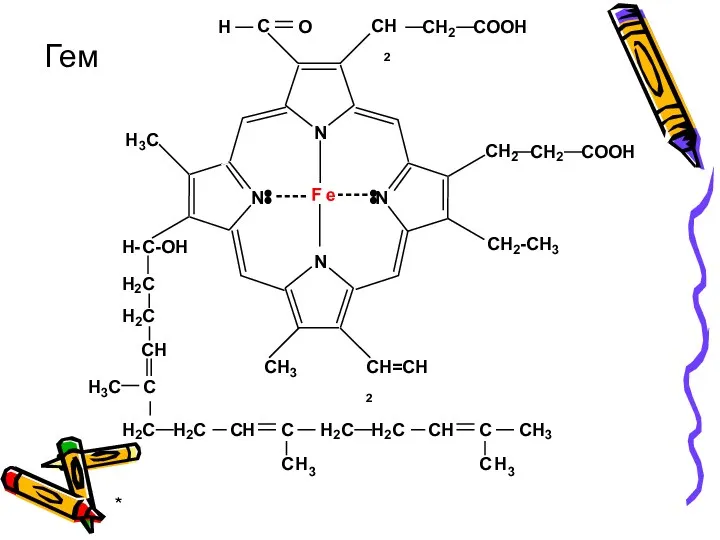
- 42. * Гем F e N N N N H C C H2 C H 2 C
- 43. * В гемоглобине и миоглобине комплексообразователь Fe2+ образует 4 связи с пофирином (= гем), 1 связь
- 44. * Оксимиоглобин поддерживает необходимое парциальное давление в тканях. Оксигемоглобин переносит О2 в ткани и связывает выделяющийся
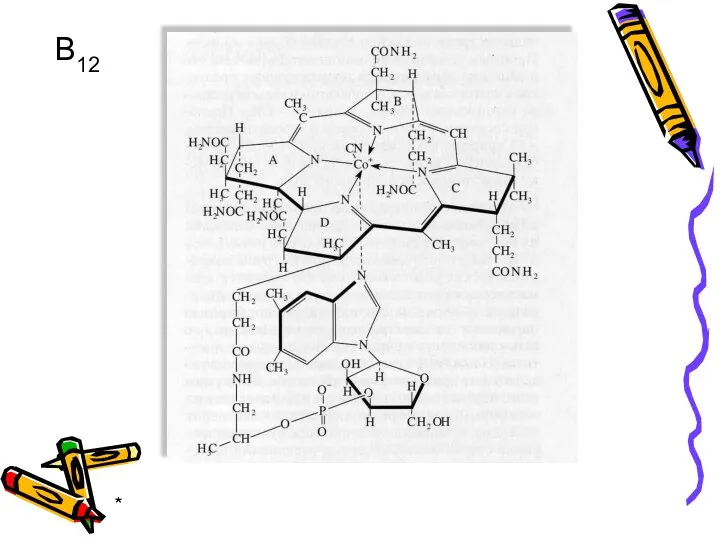
- 45. * В12
- 46. * Витамин В12 необходим для нормального кроветворения и созревания эритроцитов, синтеза аминокислот, белков, РНК, ДНК и
- 48. Скачать презентацию
![* Fe(CN)3 + 3KCN → K3[Fe(CN)6] CuSO4+5H2O→ [Cu(H2O)4]SO4·H2O NiCl2+6H2O→[Ni(H2O)6]Cl2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-2.jpg)


![* [Ni(NH3)6]Cl2 K4[Fe(CN)6] [Cr(CO)6] Внеш. сферы нет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-5.jpg)

![* [Al(OH)4]- Механизм образования донорно-акцепторных связей: Al 3+ sp3 гибридизация](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-9.jpg)








![* тетра гидроксо цинкат (II) Na+2 4] (OH)- [Zn+2 натрия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-20.jpg)
![* гекса циано феррат (III) K+3 6] (CN)- [Fe3+ калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-21.jpg)
![* гекса циано феррат (II) K+4 6] (CN)- [Fe2+ калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-22.jpg)
![* 2. по знаку заряда комплекса катионные [Ag(NH3)2]Cl анионные K3[Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-24.jpg)
![* 4. По составу и хим. свойствам - кислоты H[AuCl4] - основания [Ag(NH3)2]OH - соли [Co(NH3)6]Cl2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-25.jpg)
![* Изомерия комплексных соединений геометрическая (цис-транс-изомерия) [Pt(NH3)2Cl2] цис-изомер - противоопухолевая активность трас-изомер - не активен](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-26.jpg)
![* 2. ионизационная [Co(NH3)5Br]SO4 сульфат бромопентаамминкобальта (III) (красно-фиолетовый) [Co(NH3)5SO4]Br бромид сульфатопентаамминкобальта (III) (красный)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-27.jpg)
![* 3. гидратная [Cr(H2O)6]Cl3 хлорид гексааквахрома (III) (серо-фиолетового цвета) [Cr(H2O)5Сl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-28.jpg)
![* 4. координационная [Co(NH3)6][Cr(CN)6] гексацианохромат (III) гексаамминкобальта (III) [Cr(NH3)6][Co(CN)6] гексацианокобальтат (III) гексаамминхрома (III)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-29.jpg)

![* Вторичная (обратимая, ступенчатая): [Ag(NH3)2]+↔ [Ag(NH3)]+ + NH3 [Ag(NH3)]+↔ Ag+ + NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-31.jpg)
![* [Ag(NH3)2]+↔ Ag+ + 2NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/315961/slide-32.jpg)









 Классификация химических реакций
Классификация химических реакций Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5
Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5 Виды химической связи
Виды химической связи Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Основные виды химических связей
Основные виды химических связей Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Чистые вещества и смеси
Чистые вещества и смеси Геохимическая классификация элементов
Геохимическая классификация элементов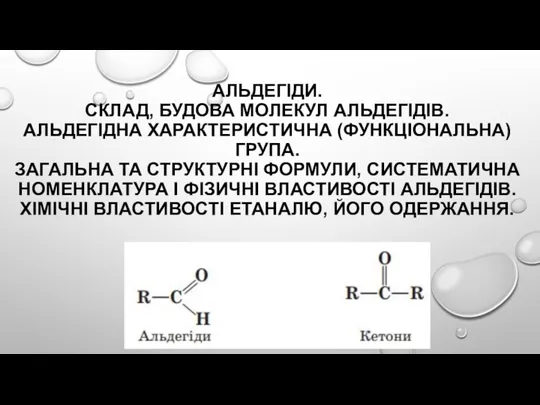 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Тепловой эффект химической реакции
Тепловой эффект химической реакции Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Водород. Положение в периодической системе
Водород. Положение в периодической системе Основные виды химических связей
Основные виды химических связей Центрифугирование в почвоведении
Центрифугирование в почвоведении Нахождение металлов в природе. Общие способы получения металлов. 9 класс
Нахождение металлов в природе. Общие способы получения металлов. 9 класс Химия нефти и газа
Химия нефти и газа Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Генетическая связь между классами неорганических веществ. Химический тренажёр
Генетическая связь между классами неорганических веществ. Химический тренажёр Түсті металдар
Түсті металдар Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Типы химических реакций в органической химии
Типы химических реакций в органической химии Трансмиссионные масла
Трансмиссионные масла Тепловой эффект химических реакций
Тепловой эффект химических реакций Титриметрический метод анализа
Титриметрический метод анализа Синтетические моющие средства. Использование их в повседневной жизни
Синтетические моющие средства. Использование их в повседневной жизни Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Общие способы получения металлов
Общие способы получения металлов Алкадиены
Алкадиены