Алкены. Ненасыщенные углеводороды, непредельные углеводороды, этиленовые углеводороды. Олефины (10 класс) презентация
Содержание
- 2. АлкЕНы – ациклические углеводороды, содержащие в молекуле помимо одинарных Ϭ-связей, одну двойную связь (Ϭ- и π-связи)
- 3. Общая формула CnH2n n=1 нет n=2 С2Н4 этен (этилен) n= 3 С3Н6 пропен (пропилен) n=4 С4Н8
- 4. Строение молекулы этилена sp2-гибридизациия атомов углерода Ϭ-связи находятся в одной плоскости, валентный угол 120° перекрывание гибридных
- 5. Изомерия и номенклатура Этилен не имеет изомеров!!! Структурная изомерия А) углеродной цепи (углеродного скелета) Б) положения
- 6. Изомерия и номенклатура 2. Межклассовая изомерия Алкены Циклоалканы Пропилен Циклопропан С3Н6 СН2 СН2 СН3= СН-СН3 СН2
- 7. Изомерия и номенклатура 3. Геометрическая изомерия (цис-транс-изомерия) С = С С = С Н Н Цис-бутен-2
- 8. Изомерия и номенклатура Номенклатура 1.Выбор главной цепи. В случае алкенов главная цепь должна содержать двойную связь.
- 9. Физические свойства алкенов C2H4 до C4H8 Газы C5H10 до C16H32 Жидкости C17H34 и далее Твёрдые вещества
- 10. Получение алкенов В промышленности алкены получают крекингом или дегидрированием алканов нефти. Термический крекинг алканов (t =
- 11. Получение алкенов Лабораторные способы получения алкенов основаны на реакциях отщепления (элиминирование) двух заместителей от соседних атомов
- 12. Получение алкенов 3. Внутримолекулярная дегидратация спиртов А) первичных СН2-СН2 CH2=CH2 + Н2O Н OH этанол этилен
- 13. Получение алкенов 4. Дегидрогалогенирование (NaOH или KOH спиртовой раствор) А) первичные галогеналканы CH3-CH2-Cl +KOH(спирт.р-р) → CH2=CH2
- 14. Получение алкенов 5. Дегалогенирование СH2Br-CH2Br-CH3 +Zn → СH2=CH-CH3 + ZnBr2 1,2-дибромпропан пропен t 6. Гидрирование алкинов
- 15. Химические свойства алкенов
- 16. Реакции присоединения 1. Гидрогалогенирование CH2=CH2 + HBr → CH3–CH2Br этилен бромэтан CH3– CH=CH2 + HBr →
- 17. Реакции присоединения 2. Гидратация (t, H3PO4 или H2SO4) CH2=CH2 + H2O → CH3 – CH2OH этилен
- 18. Реакции присоединения против правила Марковникова Присутствие пероксидов H2O2 CH2=CH–СН3 + HOН → CH2ОН – CH2–СН3 пропен
- 19. Реакции присоединения против правила Марковникова 2.Двойная связь сопряжена с электроноакцепторными заместителями (-F, -Cl, -NO2, -COOH и
- 20. Реакции присоединения 3. Галогенирование Бромирование (качественная реакция) CH2=CH2 + Br2 → CH2 Br –CH2 Br этен
- 21. Реакции присоединения 4.Гидрирование (Ni, t, p ) CH2=CH2 + H2 → CH3 –CH3 этен этан Дегидрирование
- 22. Реакции полимеризации 5.Полимеризация – процесс соединения одинаковых молекул (мономеров), протекающий за счёт разрыва кратных связей, с
- 23. Реакции полимеризации nCH3–CH=CH2 → ( – CH – CH2 – )n CH3 пропилен полипропилен nCH2=CHCl →
- 24. Реакции окисления 6.Мягкое окисление перманганатом калия (реакция Вагнера) (на холоду или t=0 ̊С) 3CH2=CH2+2KMnO4+4H2O →3CH2– CH2+2MnO2
- 25. Реакции окисления OH +KMnO4 + H2O→ +MnO2 +KOH OH CH=CH2 +KMnO4 + H2O→ CH–CH2 OH OH
- 26. Реакции окисления 7.Жесткое окисление перманганатом калия в присутствии концентрированной серной кислоты при нагревании (кач.реакция) 5СH3–CH=CH–CH3 +8KMnO4
- 27. Реакции окисления 5CH2=CH2 +12KMnO4 + 18H2SO4 → этилен 10СО2↑+6K2SO4+12MnSO4+28H2O t
- 28. Реакции окисления 8. Неполное каталитическое окисление 2CH2=CH 2+ О2 2CH2–CH 2 O окись этилена 9. Горение
- 30. Скачать презентацию
 Коррозия металлов
Коррозия металлов Аммиак. Строение, свойства, получение, применение
Аммиак. Строение, свойства, получение, применение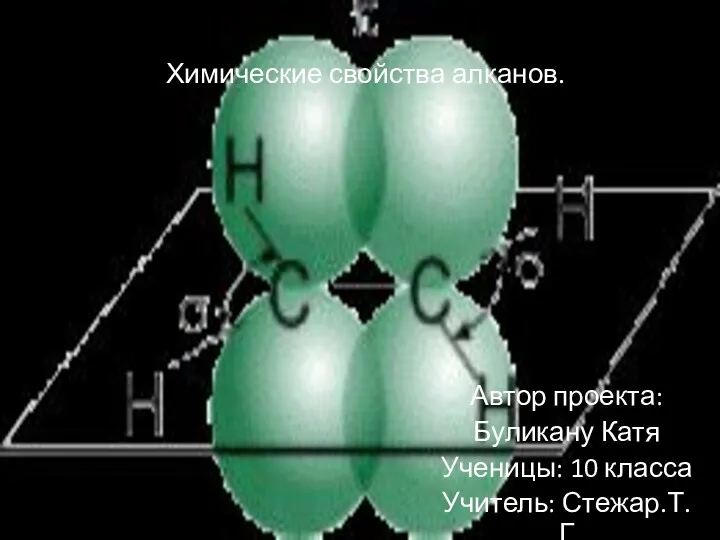 Химические свойства алканов
Химические свойства алканов Классификация химических реакций
Классификация химических реакций Углеводы. Моносахариды. Лекция 5
Углеводы. Моносахариды. Лекция 5 Химические явления. Химические реакции
Химические явления. Химические реакции Оптические свойства салических породообразующих минералов (лекция 8)
Оптические свойства салических породообразующих минералов (лекция 8) Типы химических реакций
Типы химических реакций Водород. Урок химии
Водород. Урок химии Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии Разнообразие неметаллов
Разнообразие неметаллов Силикат өнеркəсібі
Силикат өнеркəсібі Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них Каучук. Получение натурального каучука
Каучук. Получение натурального каучука Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Аллотропные модификации алмаза
Аллотропные модификации алмаза Хімічні явища в побуті
Хімічні явища в побуті Радиогеохимия метаморфических процессов
Радиогеохимия метаморфических процессов Гигиена труда при работе с пестицидами и минеральными удобрениями
Гигиена труда при работе с пестицидами и минеральными удобрениями Строение атома и атомного ядра. Изотопы
Строение атома и атомного ядра. Изотопы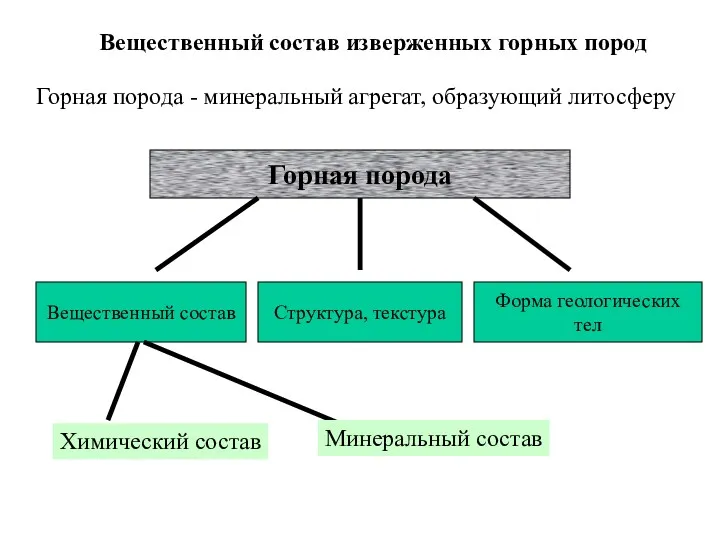 Вещественный состав изверженных горных пород
Вещественный состав изверженных горных пород Химический элемент цинк
Химический элемент цинк Гидролиз солей
Гидролиз солей Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива
Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива Магматические породы и постмагматические процессы
Магматические породы и постмагматические процессы Минеральные вещества
Минеральные вещества Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния