Слайд 2
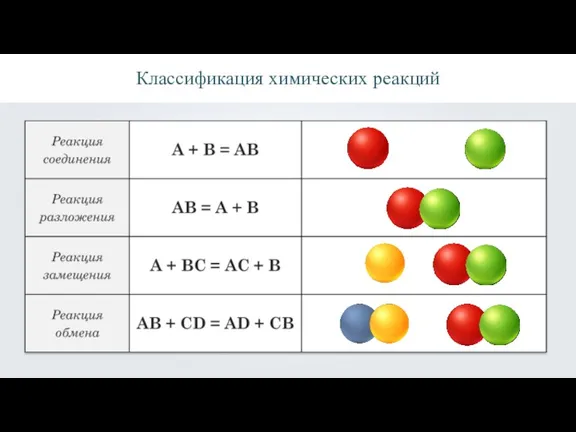
Классификация химических реакций
Слайд 3

Слайд 4

Вода — универсальный растворитель.
Слайд 5
Слайд 6
Слайд 7

Реакции разложения воды
2Н2О → 2Н2↑ + О2↑
Слайд 8
Слайд 9
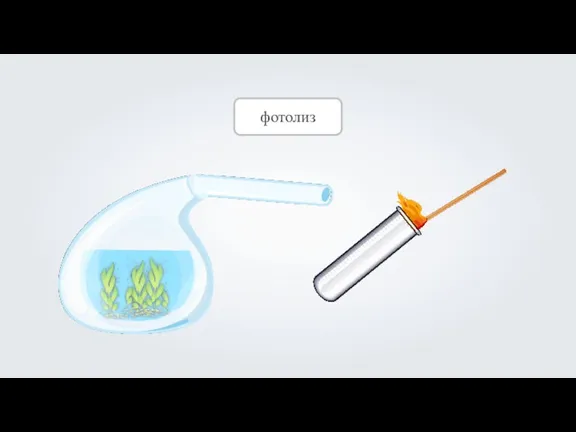
Слайд 10
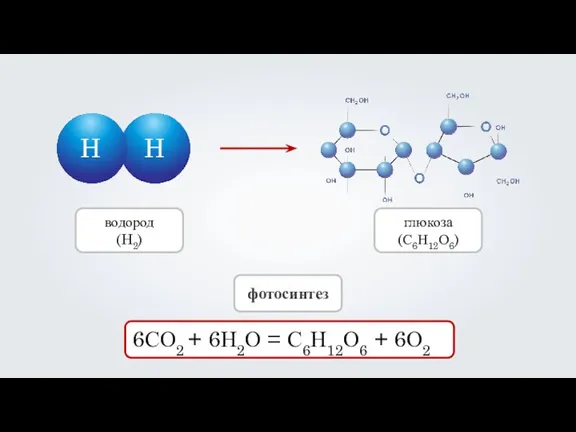
H
H
6СО2 + 6Н2О = С6Н12О6 + 6О2
фотосинтез
водород
(H2)
глюкоза
(С6Н12О6)
Слайд 11
Слайд 12
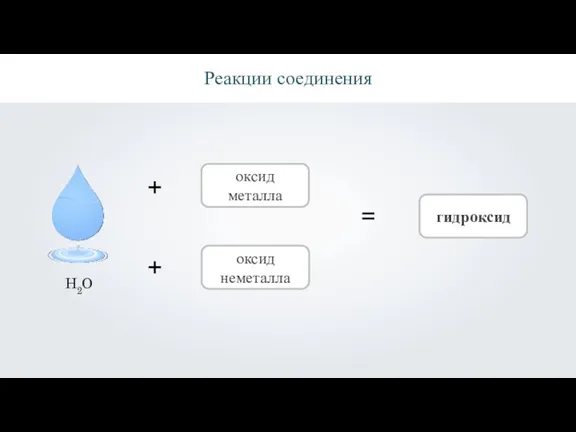
Реакции соединения
+
+
оксид металла
оксид неметалла
=
гидроксид
H2O
Слайд 13

Гидроксиды – это кислородосодержащие кислоты и основания.
Слайд 14
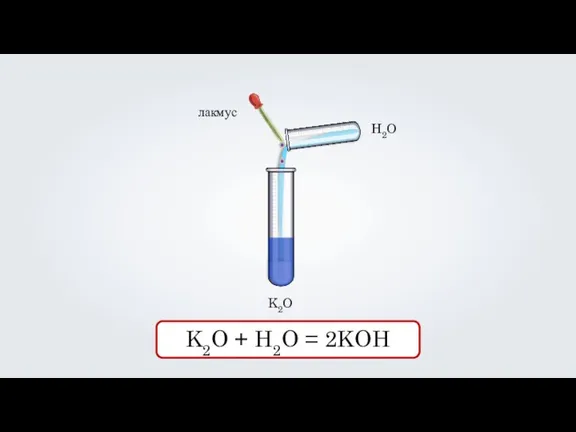
K2O
H2O
лакмус
K2O + H2O = 2KOH
Слайд 15
Слайд 16
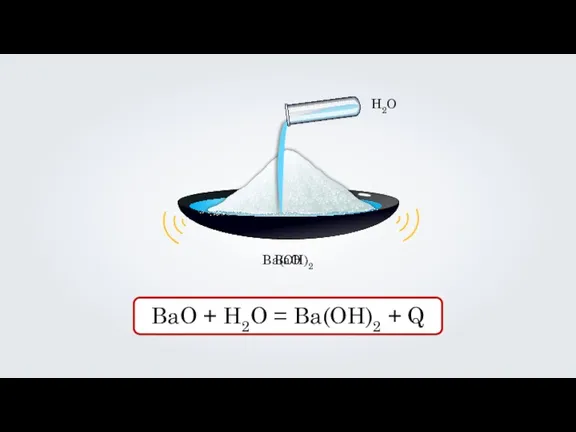
BaO
BaO + H2O = Ba(OH)2 + Q
H2O
Ba(OH)2
Слайд 17
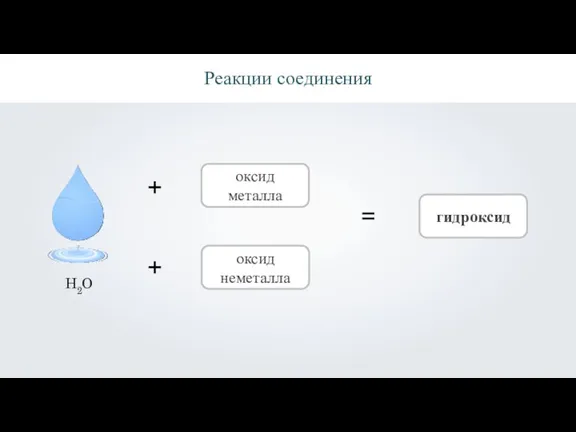
Реакции соединения
+
+
оксид металла
оксид неметалла
=
гидроксид
H2O
Слайд 18

Реакции соединения
+
+
оксид металла
оксид неметалла
=
гидроксид
H2O
Слайд 19
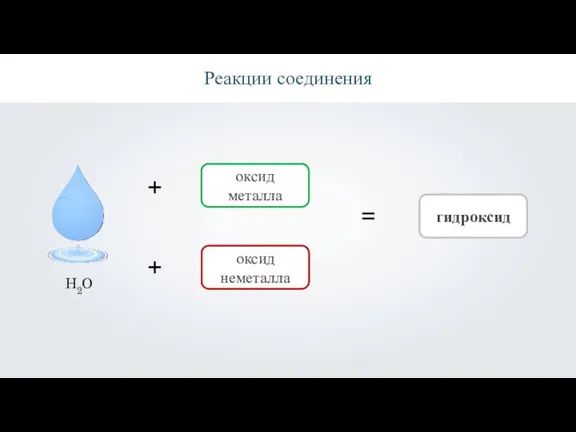
Реакции соединения
+
+
оксид металла
оксид неметалла
=
гидроксид
H2O
Слайд 20
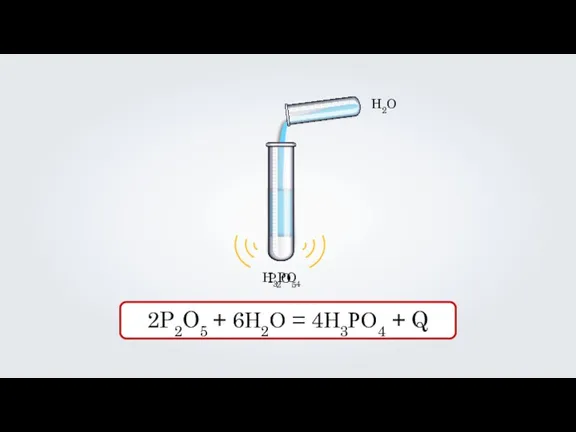
P2O5
H2O
2P2O5 + 6Н2О = 4Н3РО4 + Q
H3PO4
Слайд 21
Слайд 22

Получение серной кислоты
SO3 + H2O = H2SO4
Слайд 23

Вода реагирует с оксидами металлов и оксидами неметаллов только в том
случае, если образуется щёлочь или кислородосодержащая кислота.
Слайд 24
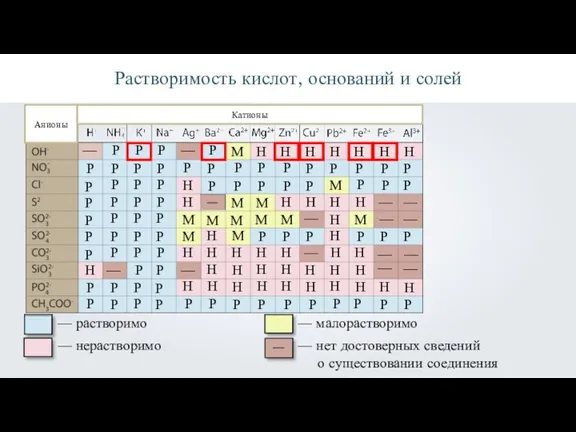
Р
Растворимость кислот, оснований и солей
Анионы
Катионы
Слайд 25

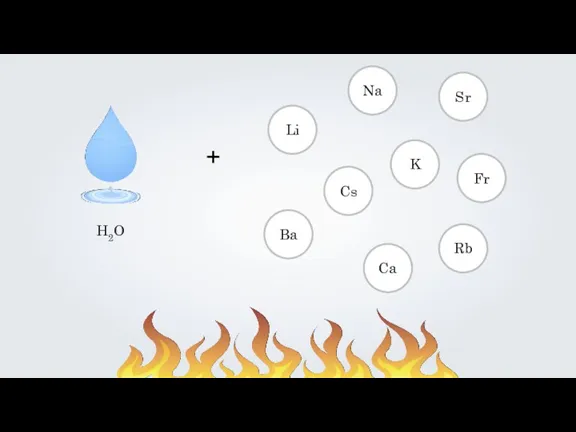
Реакции замещения
H2O
+
Li
Na
K
Ba
Cs
Rb
Fr
Sr
Ca
Слайд 26
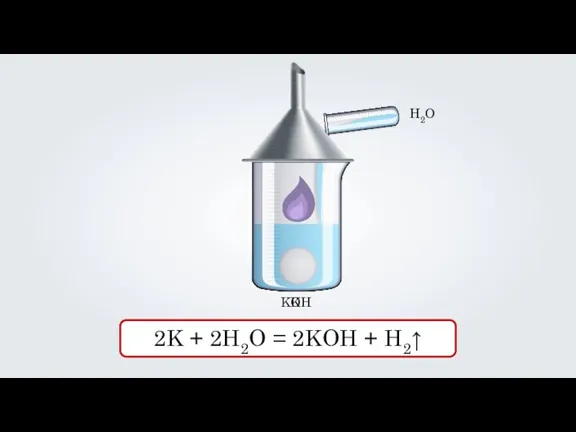
H2O
K
KOH
2K + 2H2O = 2KOH + H2↑
Слайд 27
Слайд 28
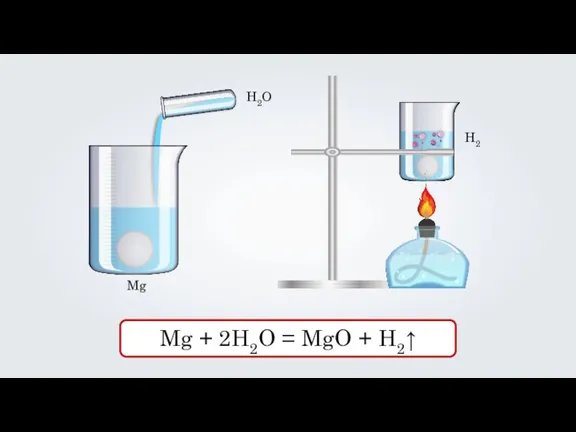
H2O
Mg
H2
Mg + 2H2O = MgO + H2↑
Слайд 29

Слайд 30

Растворимость кислот, оснований и солей
Анионы
Катионы
Р
—
Слайд 31
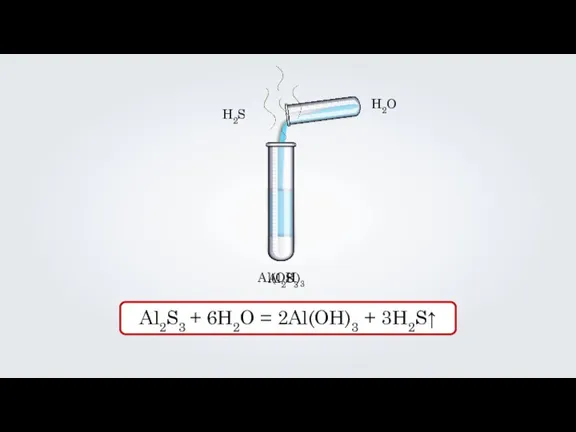
Al2S3
H2O
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S↑
Al(OH)3
H2S
Слайд 32

Органические соединения
белки
жиры
углеводы
Слайд 33

Слайд 34


































 Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Строение, реакционные способности и методы синтеза алкадиенов
Строение, реакционные способности и методы синтеза алкадиенов Карбонові кислоти
Карбонові кислоти Взаємодія кисню із складними речовинами
Взаємодія кисню із складними речовинами Енергетичний стан поверхні. Сорбційні явища. Мезопористі матеріали
Енергетичний стан поверхні. Сорбційні явища. Мезопористі матеріали Природные источники углеводородов
Природные источники углеводородов Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Азот
Азот Полимеры и их использование
Полимеры и их использование Химические свойства соляной кислоты
Химические свойства соляной кислоты Основания. Классификация оснований
Основания. Классификация оснований Жир жиру рознь. Супер омега 3
Жир жиру рознь. Супер омега 3 ГИА-9 Химия. А4
ГИА-9 Химия. А4 Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Свойства кислот и оснований в свете теории электролитической диссоциации
Свойства кислот и оснований в свете теории электролитической диссоциации 20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii
20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Алюминий и его соединения
Алюминий и его соединения Жёсткость воды
Жёсткость воды Алкадиены
Алкадиены Поліметилметакрилат
Поліметилметакрилат Жиры (триглицериды)
Жиры (триглицериды) Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Растворение. Растворимость веществ в воде. Классификация растворов
Растворение. Растворимость веществ в воде. Классификация растворов Алюминий
Алюминий Защита металлов от коррозии
Защита металлов от коррозии