Содержание
- 2. Физические свойства Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота, хлористый водород) — раствор хлороводорода (HCl) в воде,
- 3. Кислотами называют сложные соединения, в состав которых входят атомы водорода, имеющие способность замещаться атомами металлов, и
- 4. Цель: исследовать химические свойства соляной кислоты, повторить реакции ионного обмена и окислительно-восстановительные реакции; сформировать навыки работы
- 5. Материалы: раствор соляной кислоты, фенолфталеин, метиловый оранжевый, универсальная индикаторная бумага, цинк, медь, оксид меди(II), оксид цинка,
- 6. Опыт №1 Действие индикаторов на раствор соляной кислоты В три пробирки налейте раствор соляной кислоты. В
- 7. Наблюдаемые явления: раствор лакмуса становится красным (универсальная индикаторная бумага приобретает малиновый цвет, метиловый оранжевый - розовеет).
- 8. Опыт №2 Реакция соляной кислоты с металлами В две пробирки осторожно налейте раствор соляной кислоты. В
- 9. В две пробирки нальем соляную кислоту (раствор серной кислоты). В одну добавим стружки цинка, а в
- 10. Опыт №3 Реакция соляной кислоты с основными и амфотерными оксидами В одну пробирку поместите небольшое количество
- 11. В пробирку с соляной кислотой насыпаем на кончике шпателя черный порошок оксида меди (II). Укрепляем пробирку
- 12. Вывод: кислоты реагируют с оксидами металлов с образованием соли и воды.
- 13. Опыт №4 Взаимодействие соляной кислоты с основаниями В пробирку налейте 2 мл раствора гидроксида калия и
- 14. Взаимодействие кислот с основаниями В пробирку наливаем 2-3 мл раствора гидроксида натрия. Добавляем 1-2 капли раствора
- 15. Опыт №5 Взаимодействие соляной кислоты с солями. а) К раствору карбоната натрия добавьте раствор соляной кислоты.
- 16. Взаимодействие кислот с солями 1. В пробирку наливаем раствор карбоната натрия. Добавляем соляную кислоту (раствор серной
- 17. 2. В пробирку наливаем соляную кислоту и добавляем 1-2 капли нитрата серебра. Наблюдаемые явления: выпадает творожистый
- 18. Вывод Вывод (впишите недостающие слова): HCI это формула _______ кислоты. С помощью опытов мы убедилить, что
- 20. Скачать презентацию

















 Мембранное материаловедение. Топливные элементы
Мембранное материаловедение. Топливные элементы Кислоты, их классификация и свойства. 8 класс
Кислоты, их классификация и свойства. 8 класс Химические формулы
Химические формулы Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Количественное определение лекарственных веществ
Количественное определение лекарственных веществ Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Относительная молекулярная масса
Относительная молекулярная масса Силіцій
Силіцій Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Щелочные металлы
Щелочные металлы Азотсодержащие органические соединения. Лекция 8
Азотсодержащие органические соединения. Лекция 8 Щелочные металлы
Щелочные металлы Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов Органическая химия. Пособие
Органическая химия. Пособие Правила техники безопасности. Приемы обращения с лабораторным оборудованием. Урок №2. Практическая работа №1
Правила техники безопасности. Приемы обращения с лабораторным оборудованием. Урок №2. Практическая работа №1 Минералы
Минералы Биофизическая химия. Предмет и задачи курса
Биофизическая химия. Предмет и задачи курса Строение атома пз и пс Д.И. Менделеева в свете квантовомеханической теории строения атома
Строение атома пз и пс Д.И. Менделеева в свете квантовомеханической теории строения атома Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Стан електронів у атомі
Стан електронів у атомі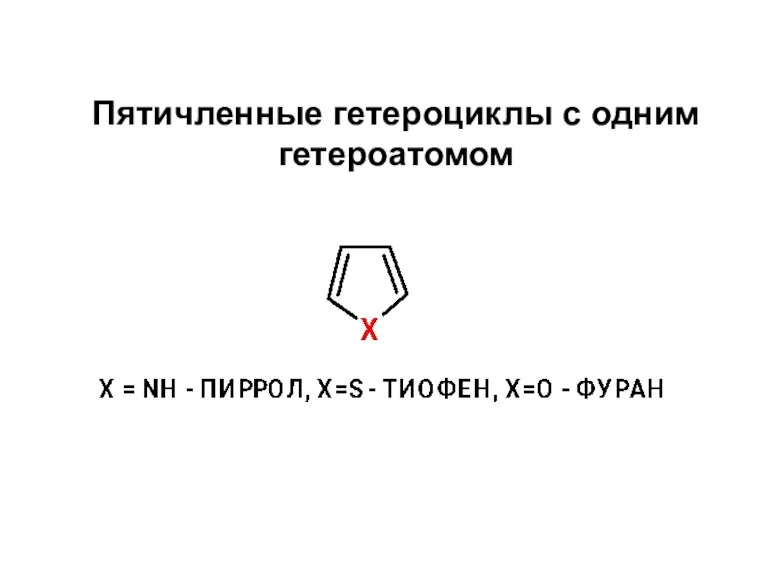 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Химические свойства белков
Химические свойства белков Спирты. Классификация спиртов
Спирты. Классификация спиртов ЕГЭ по химии. Анализ результатов решения (часть 2)
ЕГЭ по химии. Анализ результатов решения (часть 2) Білки та амінокислоти
Білки та амінокислоти Кислоты. Растворы всех кислот
Кислоты. Растворы всех кислот Связь структуры и функций химических соединений. Задачи QSAR
Связь структуры и функций химических соединений. Задачи QSAR Азот и его соединения
Азот и его соединения